Kohlenstoff
| |||||||||||||||||||||||||
| Allgemeen | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Naam, Teken, Atomtall | Kohlenstoff, C, 6 | ||||||||||||||||||||||||
| Cheemsch Serie | Nichmetall | ||||||||||||||||||||||||
| Klöör | swart (Graphit) ahn Klöör (Demant) | ||||||||||||||||||||||||
| Atommass | 12,0107 u | ||||||||||||||||||||||||
| Elektronenkonfiguratschoon | 1s2 2s2 2p2 | ||||||||||||||||||||||||
| Elektronen je Schaal | 2,4 | ||||||||||||||||||||||||
| Physikaalsche Egenschoppen | |||||||||||||||||||||||||
| Phaas | Faststoff | ||||||||||||||||||||||||
| Dicht | 2,267 (Graphit) 3,513 (Demant) g·cm−3 (bi RT) | ||||||||||||||||||||||||
| Tripelpunkt | 4300-4700 K, 10 MPa | ||||||||||||||||||||||||
| Atomare Egenschoppen | |||||||||||||||||||||||||
| Kristallstruktur | hexagonal | ||||||||||||||||||||||||
| Ionisatschoonsenergien | 1.: 1086,5 kJ/mol | ||||||||||||||||||||||||
| 2.: 2352,6 kJ/mol | |||||||||||||||||||||||||
| 3.: 4620,5 kJ/mol | |||||||||||||||||||||||||
| Atomradius | 70 pm | ||||||||||||||||||||||||
| Annere Egenschoppen | |||||||||||||||||||||||||
| Isotopen (Utwahl) | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
De Kohlenstoff (latiensch: Carbonium) is en Element ut dat Periodensystem un tellt to de Nichtmetallen. Dat Atomteken is C un de Atomtall is 6. In de Natur kann Kohlenstoff gediegen oder cheemsch bunnen vörkamen. Dat Kohlenstoffatom wiest en sünnere Anorden vun de Elektronen in de Hüll op, neemlich en halfvulle L-Schaal. Dordör kann Kohlenstoff bannig komplexe Molekülen billn un hett vun all cheemsche Elementen de gröttste Männigkeit vun Verbinnen. Kohlenstoffverbinnen sünd de molekulare Grundlaag vun all Leven op de Eer un stellt dormit ok de Grundlaag dor för de orgaansche Chemie.
Vörkamen
[ännern | Bornkood ännern]Kohlenstoff is en essentiell Element vun de Biosphäär op de Eer. De Kohlenstoff kummt in all Leevwesen vör un is na’t Gewicht dat bedüdenste Element na’n Suerstoff (Water). All Geweev, worut de Leevwesens opboet sünd, besteiht ut orgaansche Kohlenstoffverbinnen.
Ut Sicht vun de Geologie dorgegen kummt de Kohlenstoff nich övermatig faken vör. Man finnt em in de nich belevten Natur in elementare Form (Demant, Graphit) as ok in Verbinnen. Demant warrt vör allen in Afrika (sünners in Süüdafrika un in de Demokraatschen Republiek Kongo) un in Russland anfunnen. Faken is Demant in vulkaansche Stenen as Kimberlit optodecken. Graphit kummt teemlich roor in Metamorphiten vör, de Kohlenstoff bargt. De wichtigsten Vörkamen sünd in Indien un de Volksrepubliek China.
An’n fakensten finnt een Kohlenstoff in Form vun anorgaansch Carbonatsteen (ruchweg 2,8 · 1016 t). Carbonatstenen gifft dat an vele Steden un deelwies billt se hele Bargen. En bekannt Bispeel för en Carbonatbargland sünd de Dolomiten in Italien. Dat gifft verschedene Carbonat-Mineralen. De wichtigsten dorvun sünd Calciumcarbonat (CaCO3, mit de Modifikatschonen Kalksteen, Kried un Marmor), Calcium-Magnesium-Carbonat (CaCO3 · MgCO3, Dolomit), Iesen(II)-carbonat (FeCO3, Iesenspat) un Zinkcarbonat (ZnCO3, Zinkspat).
Kohlenstoff gifft dat ok in de Form vun de fossilen Brennstoffen Kahl, Eerdööl un Eerdgas. Aver dat sünd keen reine Kohlenstoffverbinnen, man Mischen ut vele verschedene orgaansche Verbinnen. Se entstaht dör Ümwanneln vun de Överresten vun Planten (Kahl) un Deerten (Eerdööl un -gas) ünner hogen Druck. Bedüdende Vörkamen för Kahlen gifft dat in de USA, China un Russland. In Düütschland liggt en grote Lagersteed in’t Ruhrrebeet. De wichtigsten Vörkamen vun Eerdööl leegt op’t araabsche Halfeiland (Irak, Saudi-Arabien). Wietere Fundöörd sünd in’n Gulf vun Mexiko un in de Noordsee.
Ok in de Luft gifft dat Kohlenstoff, neemlich as Kohlenstoffdioxid, wat en Andeel an de Luft hett vun ruchweg 0,04 %. Dat Gas kummt dör’t Verbrennen vun Verbinnen tostannen, de Kohlenstoff bargt so as de fossilen Energiedrägers. CO2 is ok in’t Seewater löst un hett dor en Massenandeel vun üm un bi 0,01 %.
De gröttste Deel vun’n Kohlenstoff op de Eer is in de buteren Steenhüll, de Lithosphäär, spiekert. All annern Vörkamen maakt tosamen blots ruchweg en Dusendstel vun de Samtmengde an Kohlenstoff ut.
Formen vun’n Kohlenstoff
[ännern | Bornkood ännern]As Element kummt Kohlenstoff in dree verschedene Modifikatschonen vör (Allotropie), nämlich as Demant, Graphit un Fulleren. Bito gifft dat noch annere Formen vun’n elementaren Kohlenstoff. De ünnerscheedlichen Strukturen hebbt mit den Opbo vun’t Atom to doon.
Atommodell vun’n Kohlenstoff
[ännern | Bornkood ännern]Woans de ünnerscheedlichen Utprägen vun’n Kohlenstoff tostannen kamen doot, warrt dör dat Modell vun de Atom- un Molekülorbitalen verklort:
Kohlenstoff hett söss Elektronen. Na dat Schalenmodell besett twee dorvun de binnere 1s-Schaal un twee wietere sitt op de 2s-Schaal. De annern beiden Elektronen warrt vun’t 2px- un vun’t 2py- Niveau opnahmen. An cheemsche Reakschonen sünd blots de veer buteren Elektronen vun de tweeten Schaal bedeeligt. De Wohrschienlichkeit, sik an en Steed optohollen is bi Elektronen in en s-Niveau as’n Kugel formt. Op en p-Niveau is se anisotrop un de Elektronen bewegt sik in en drapenförmigen Ruum mit elk en Drapen links un rechts vun de Mitt op de X-Ass, wenn man sik dat Atom in’n Oorsprung vun en karteesch Koordinatensystem vörstellt. Piel dorto staht de py- un pz-Orbitalen.
Demant (sp3) Struktur
[ännern | Bornkood ännern]
Dat 2s-Niveau kann mit de 3 2p-Niveaus hybridiseeren un veer sp³-Orbitalen billn, de vun jemehr Energie her gliekweertig sünd. Dat kann een sik so verkloren, dat een vun de s-Elektronen in dat vörher leddige p-Orbital böhrt warrt, wobi sik de Energien vun de Orbitalen anglieken doot. Disse Orbitalen hebbt nu en langtogene asymmetrische Drapenform. Wiel de p-Orbitalen noch spegelsymmetrisch to’n Middelpunkt anordent weern, wiest sik de Hybridorbitalen nu külenordig in en Richt verlängert. Dat Bild wiest de Hööftkülen; de Nevenkülen sünd vun wegen de Översichtlichkeit weglaten worrn. De veer sp³-Orbitalen sünd symmetrisch mit den gröttst mööglichen Afstand in’n Ruum utricht un wiest in de Ecken vun en Tetraeder, den een sik vörstellen kann.
Wenn sik de sp³-Orbitalen vun Atomen överlappen doot, künnt se faste kovalente Binnen ingahn, de sik denn in de tetraedrischen Struktur wedderspegelt. Se billt dat Grundgerüst vun’t Demantgidder
Graphit (sp2) Struktur
[ännern | Bornkood ännern]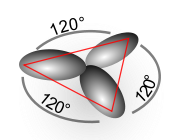
Wenn blots twee vun de 3 mööglichen Orbitalen an’t Hybridiseeren bedeeligt sünd, denn kamt de so nöömten sp²-Orbitalen dorbi rut. Disse sp²- Orbitalen richt sik pielliek to dat överblevene p-Orbital ut. Wenn dat p-Orbital to’n Bispeel piel to de x-y-Even steiht, denn leegt de sp²-Orbitalen symmetrisch utricht in de x-y-Even un hebbt to’nanner den glieken Winkel vun 120°. Dat Bild wiest, woans een sik dat vörstellen mutt. Dat p-Orbital, dat nich hybridiseert is, is dorbi weglaten worrn.
Ok sp²-Kohlenstoff-Atomen künnt mitenanner kovalente Binnen ingahn, de denn in een Even leegt. Jemehr Struktur is hexagonal – dat is de Grundstruktur vun de Planarevenen vun’n Graphit. De fre’en p-Orbitalen künnt aver ok ünner’nanner wesselwirken. Se formt de π-Binnen mit düütlich lüttere Binnenenergien as de σ-Binnen vun de sp² oder sp³-Orbitalen.
Cheemsch warrt dorbi vun en Dubbelbinnen snackt. De Schrievwies C=C betütt den ünnerscheedlichen Charakter vun de beiden Binnen nich mit in. De Binnenenergie vun de demantordigen tetraedrischen sp³-Eenfachbinnen 'C-C' liggt bi 350 kJ/mol. De vun de graphitordigen hexagonalen sp²-DubbelbinnenC=C liggt blots üm 260 kJ/mol höger. In en Kohlenstoffring mit söss Kohlenstoffatomen warrt de π-Binnen bestänniger dör dat Delokaliseeren vun de Elektronen binnen den Ring (kiek ok bi Benzol).
Dreefack (sp1) Binnen
[ännern | Bornkood ännern]Wenn blots een p-Orbital mit dat s-Orbital hybridiseert, entstaht twee linear anordente Binnenkülen. Wenn se an de x-Ass langs orienteert sünd, wiest de fre’en p-Orbitalen in y- un in z-Richt. Twee sp-hybridiseerte Atomen künnt en Kohlenstoff-Dreefackbinnen formen. En Bispeel is dat Gas Ethin (Acetylen) HC ≡ CH. Dat heet also, dat sp³-Binnen dreedimensionale Strukturen formen doot, wiel sp²-Binnen tweedimensionale un sp¹-Binnen hööchstens eendimensonale Keden, as to’n Bispeel H-C≡C-C≡C-H billt.
Modifikatschonen
[ännern | Bornkood ännern]
Demant
[ännern | Bornkood ännern]- Hööftartikel: Demant
De Kohlenstoff-Atomen, de sp³-kovalent tetragonal bunnen sünd, hebbt keen fre’en Elektronen. Dat Material is dorüm en elektrischen Isolater mit en Bandlück vun 5,45 eV, de sichtbor Licht nich absorbeert. Dat Doteeren mit Frömdatomen tüügt Tostännen in de Bandlück un ännert dormit de optischen un elektrischen Egenschoppen. So kummt to’n Bispeel de licht gele Farvtoon vun vele natürliche Demanten op Stickstoff torüchtoföhren, wiel Daiamant, de mit Bor doteert sünd, halfleiden sünd un en licht blaue Klöör opwiest. Ünner Luftafsluss wannelt sik Demant bi Temperaturen üm 1500 °C in Graphit üm. An de Luft verbrennt Demant al bi ruchweg 700–800 °C to Kohlenstoffdioxid.
Ünner Normalbedingen (1 bar, 25 °C) gellt Demant as metabestännige Form vun’n Kohlenstoff. Dat is na ne’ere Forscherarbeiten aver nich mehr seker, vun wegen dat
- de thermodynaamsche Bestännigkeit to siete P-T-Bedingen blots extrapoleert is,
- bi Ünnersöken vun’t Gliekgewicht de Influss vun’t Ümfeld – lütte Sporen vun Verunreinigen, de ünner de hüütigen Detekschoonsgrenz leegt, künnt al düchtige Utwirken op de Gliekgewichtslaag vun en Reakschoon hebben – nich beacht worrn sünd[1],
- Experimenten vun chinees’sche Wetenschoppler wiest, dat in en Reakschoon twüschen metallsch Natrium un Magnesiumcarbonat Kohlenstoff un Demant bestännig blangenenanner bestaht.
En bannig rore Modifikatschoon vun’n Demant is de Lonsdaleit, de ok hexagonal Demant nöömt warrt. Disse Form kummt tostannen, wenn Graphit dör en Schockvörgang, also bi hogen Durck un hoge Temperaturen as bi’n Impakt, in Demant ümwannelt warrt. De hexagonale Charakter vun de Kristallstruktur blifft dorbi bestahn, man in’n Gegensatz to Graphit is nu jeed Kohlenstoffatom an veer annere kovalent bunnen.
Graphit
[ännern | Bornkood ännern]- Hööftartikel: Graphit
De Kohlenstoff-Atomen, de sp²-kovalent hexagonal bunnen sünd, billt bannig faste Evenen. Ünnerenanner sünd disse Evenen man blots rööd över de swacken Van-der-Waals-Kräft bunnen. Makroskopisch kummt dorüm dat Splitten langs de Planareven an’n düütlichsten rut. Vun wegen dat de Even so dünn sünd, markt een vun jemehr bannige Fastigkeit kuum wat.
Dör disse Struktur is Graphit en düchtig anisotrop Mineral: An de Kristallevenen langs verhollt sik Graphit as en düchtig goden Leider för Warms un för elektrischen Stroom. De Leddanlaag is dorgegen teemlich slecht vun een Even to de nächsten.
Fullerenen
[ännern | Bornkood ännern]
- Hööftartikel: Fulleren
En regulär hexagonal Wavenmuster, as dat de Kohelnstoffatomen in de Evenen vun’n Graphit utbillt, is flachig. Wenn een nu een poor vun de Sössecken dör Fiefecken uttuuscht, kamt dorbi krümmte Flachen rut, de in sünnere Anorden vun de Fief- un Sössringen slatene Körpers billt. De Fullerenen sünd solke Strukturen. Dorbi leegt de sp²-Binnen nich mehr in een Even, man se billt en rüümlich afslatene Figur. De lüttste möögliche Struktur besteiht dorbi blots noch ut Fiefecken un bruukt twintig Kohlenstoffatomen. De Figur, de dorbi tostannen kummt, is en Pentagon-Dodekaeder. Dit eenfachste Fulleren is bit hüüt blots dör Massenspektrometrie nawiest worrn.
En vun de bestännigsten Fullerenen bestieht ut sösstig Kohlenstoffatomen un bargt blangen Sössecken blots Fiefecken, de mit keen anner’t Fiefeck en gemeensome Kant hebbt. Dat Muster (en afstumpten Ikosaeder) gliekt en Football na olle Oort. De Struktur warrt to Ehren vun Richard Buckminster Fuller ok as Buckminster-Fulleren betekent. De Molekül-Kugeln vun de Fullerenen sünd ünnerenanner över temmlich swacke Van-der-Waals-Kräft bunnen, jüst so as de Basalevenen vun’n Graphit. In de Twüschentiet sünd ’n Reeg vun Fullerenen mit ünnerscheedliche Grötten isoleert un deelwies ok kristalliseert worrn. Man kann jem dorüm as richtige Modifikatschonen ansehn. Fullerenen kamt wohrschienlich in all Orden vun Sott vör, t. B. ok in’n Sott vun Kersenflammen.
Annere Formen
[ännern | Bornkood ännern]Amorph Kohlenstoff
[ännern | Bornkood ännern]In’n amorphen Kohlenstoff (a-C) sünd de Atomen ahn wietrecken Orden vernett. Dat Material kann mit all möögliche sp²:sp³-Proportschonen synthetiseert warrn, wobi de Egenschoppen vun’t Material langsom vun’n Graphit to de vun’n Demant övergaht. In de Industrie warrt dorför faken de Utdruck Diamond like Coating oder Diamond like Carbon (DLC) bruukt.
Bi en sp³ Hybridiseerandeel vun mehr as 70 % warrt vun tetraedrisch amorphen Kohlenstoff (ta-C) snackt. Dit Material wiest en hogen elektrisch Wedderstandelektrischen Wedderstand un optische Transparenz op un is bannig hard. De Synthees kann dör PVD- oder PECVD-Methoden maakt warrn. Dat Materialwarrt dorbi as Schicht afscheedt (amorphe Kohlenstoffschicht).
Kohlenstoff-Fesen
[ännern | Bornkood ännern]- Hööftartikel: Kohlenstofffees
Kohlenstofffesen bestaht ut sp²-bunnen Kohlenstoff as bi’n Graphit. Isotorpe Fesen verhollt sik as polykristallinen Graphit un hebbt blots en lütte Fastigkeit. Matten un Packen ut Fesen warrt to’n Bispeel för Warmsafdichten bruukt. Dör Strecken bi’t Herstellen is dat mööglich, de Basalevenen na de Feesass uttorichten. Dordör kriggt man hoochfaste Fesen mit Egenschoppen, de langs de Basalevenen meist an de vun’n Graphit rankamt. Anisotrope Kohlenstofffesen sünd licht, utermatig stief un fast un warrt in Verbundwarkstoffen insett.
Glaskohlenstoff
[ännern | Bornkood ännern]- Hööftartikel:Glaskohlenstoff.
Glaskohlenstoff („Glassy Carbon“) is en hoochtechnoloogschen Warkstoff ut reinen Kohlenstoff, de de Egenschoppen vun Glas un Keramik mit de vun’n Graphit verbinnt. In’n Gegendeel to Graphit hett Glaskohlenstoff en fullerenordige Fienstruktur un bargt dordör en breet Rebeet vun gode Materialegenschoppen. De Leddanlaag is to’n Bispeel sieter as bi’n Graphit.
Graphen
[ännern | Bornkood ännern]- Hööftartikel: Graphen
As Graphen warrt en Graphit-Basaleven vun sp²-hybridiseert Kohlenstoff betekent. De dünnen Schichten kann man dör cheemsch Splitten vun Graphit maken. In Kunststoff inbett egent sik dat as Utgangsmaterial för ne’e Verbundwarkstoffen oder för Ünnersöken vun tweedimensionale Kristallen.
Aktivkahl
[ännern | Bornkood ännern]- Hööftartikel: Aktivkahl
Wenn een orgaansche Materialen as to’n Bispeel de Schalen vun Kokosnütt vörsichtig graphiteert, kummt dorbi en porösen Kohlenstoff bi rut. De Hollrüüm sünd dorbi mitenanner verbunnen as bi’n Swamm un billt dordör en bannig grote binnere Böverflach. Aktivkahl kann löste Stoffen in lütte Kunzentratschonen ut Fletigkeiten filtern un Gasen absorbeeren.
Sott
[ännern | Bornkood ännern]- Hööftartikel: Sott
Sott is ok en Kohlenstoff op Grundlaag vun’n Graphit. De Egenschopp vun’n Graphit kamt üm so duller rut, je reiner de Sott is. Sott vun Lampen un Kersen is tomeist stark mit orgaansche Verbinnen verunreinigt, de dat Utbillen vun gröttere Graphit-Verbännen hinnert.
Kohlenstoffnanoröhren
[ännern | Bornkood ännern]- Hööftartikel: Kohlenstoffnanoröhr
En wietere Form stellt de sp²-bunnen Kohlenstoffatomen dor, dde as’n Zylinder anordent sünd. Jemehr Geometrie kummt ut en evene Graphitschicht tostannen, de to’n Zylinder oprullt warrt. Dorbi entsteiht en Röhr, de tosätzlich noch verdreiht wesen kann, wodör sik de elektrischen Egenschoppen ännert. Dat is mööglich, dat mehrere eenwannige Röhren zentreert inenanner leegt. Dorüm warrt twüschen multiwalled carbon nanotubes (MWCNT) un single-walled carbon nanotubes (SWCNT) ünnerscheedt.
Bito gifft dat so nöömte Carbon nanobuds, de de Egenschoppen vun Kohlenstoffnanoröhren un Fullerenen mitenanner kombineert.
Kohlenstoffnanoschuum
[ännern | Bornkood ännern]Kohlenstoffnanoschuum is en tofallig orienteerte, nettordige Anorden vun Kohlenstoff-Hopens, ruchweg so as de Glaskohlenstoff aver mit düütlich gröttere Hollrüüm. Jemehr dörsnittliche Dörmeter liggt bi söss bit negen Nanometer. Ut technische Sicht is Kohlenstoffnanoschuum in Aerogel mit en Dicht vun 0,2 bit 1,0 g/cm³. Deelwies gifft dat noch sietere Dichten mit ungewöhnliche magneetsche Egenschoppen.
Isotopen
[ännern | Bornkood ännern]Vun’n Kohlenstoff gifft dat twee bestännige Isotopen 12C un 13C, wovun dat eerste to 98,9 % in de Natur vörkummt un dat annere blots to 1,1 %. 12C is as Betogspunkt to’n Meten vun Atommassen defineert worrn. 13C kann bi NMR-spektroskoopsche Ünnersöken insett warrn.
Blangen de bestännigen gifft dat ok noch en Reeg vun radioaktive Isotopen. Dat bekannste dorünner is dat 14C mit en Halfweertstiet vun 5.730 Johren. Dit Isotop entsteiht in de Atmosphäär dör en natürliche Karnreakschoon ut dat Stickstoff-Isotop 14N. Orgaansche Verbinnen nehmt also 14C in en sünnere Proportschoon to de bestännigen Isotopen op. Wenn disse orgaansche Verbinnen nu aver vun de Atmosphäär, also vun de Luft, afslaten warrt, ännert sik disse Proportschoon mit de Tiet dör radioaktiven Verfall. Dör’t Bestimmen vun de 14C-Proportschoon to de bestännigen Isotopen kann man also op dat Öller torüchsluten. Disse Radiokarbonmethood warrt vör allen in de Archäologie anwennt.
Rohstoffen un Winnen
[ännern | Bornkood ännern]Dat Inkahlen is en Värgang, bi den över geoloogsche Tietrüüm de Kohlenstoffandeel vun orgaansche Stoffen anstiggt. Disse Vörgang hett to’n Entstahn vun Bruun- un Steenkahl ut Plantenöverresten vun’t Karbon föhrt. En gau Verfohren is dat Ophitten ünner Inertgas. De Karboniseeren (bit ~1900 °C) un Graphiteeren oder Graühitiseeren (baven vun 2000 °C) föhrt to’n bannig Kohlenstoffanriekern in Minuuten oder wenige Daag – afhangig vun de Materialmengde.
As Rohstoffen to’n Winnen vun Kohlenstoff kamt Anthrazitkahl, Steenkahl, Koks (karboniseerte Steenkahl), Bruunkahl, Eerdööl, Eerdgas, Torf, Holt un Holtkahl (karboniseert Holt) in Fraag.
Verbinnen
[ännern | Bornkood ännern]Kohlenstoff is dat Element, dat vun all Elementen de meisten Verbinnen billn kann. Dorvör liggt blots noch de Waterstoff, man ok bl.ots, vun wegen dat Waterstoff in meist all Kohlenstoffverbinnen mit in is. Sünnerheiten ’n Kohlenstoff sünd, dat he Keden un Ringen mit sik sülvst un annere Elementen billn kann, as ok Dubbel- un Dreefackbinnen ünner Bedeeligen vun π-Orbitalen. Dör sien middelstarke Elektronegativität hett Kohlenstoff en goot Binnenvermögen to elektropositivere as ok to elektronegativere Elementen. All Oxidatschoonstopen vun -IV bit +IV kamt in de Natur in anorgaansche un orgaansche Verbinnen vör.
Bit op wenige Utnahmen warrt Verbinnen vun Kohlenstoff to de orgaanschen Chemie rekent, de mitünner ok as de „Chemie vun’n Kohlenstoff“ betekent warrt. De orgaansche Chemie ümfaat mehr Verbinnen as de hele anorgaansche Chemie, vun wegen dat de Kohlenstoff de Egenoort hett, lange Keden un kovalente Binnen mit annere Atomen to billn. Ok de Biochemie is en Deel vun de orgaanschen Kohlenstoffchemie. To de eefachsten Verbinnen tellt beiden Alkanen Methan un Ethan.
To de anorgaanschen Verbinnen warrt traditschonell blots en poor Kohlenstoffverbinnen tellt. Dorünner sünd de Suerstoffverbinnen an bedüdensten:

- Carbiden sünd Kohlenstoffverbinnen mit annere Elementen na den Tyyp ExCy, bi de de Kohlenstoff de elektronegativere Reakschoonspartner is. Vele Metallen künnt Carbiden billn. Se sünd deelwies bannig hard un warrt för Sniedwarktüüch bruukt, as to’n Bispeel Wolframcarbid.
- Kohlenstoffmonoxid (CO) is en düchtig giftig Gas, dat en düchtig reduzeeren Wirken opwiest. En grote Rull speelt dat Gas to’n Bispeel bi’t Metallverhütten (t. B. vun Iesen).

- Kohlenstoffdioxid (CO2) is en Drievhuusgas, dat in grote Mengden freesett warrt, wenn fossile Energiedrägers as Kahl, Eerdööl oder Eerdgas verbrennt warrt. Butendem warrt dat Gas vun de meisten Leevwesen utatent un vun de Planten bi de Fotosynthees verbruukt. Kohlenstoffdioxid hett vundaag en Andeel vun ruchweg 0,038 % an de Atmosphäär. In de Tiet vör de Industrie leeg de Andeel bi 0,028 %
- Kohlensüür (H2CO3) is en metabestännig Produkt ut Water un CO2, dat in’t Water löst is. Dorbi hannelt sik dat üm en middelstarke Süür, de aver wegen ehr stännige Ümwanneln twüschen Kohlensüür un löst CO2 tomeist mit CO2 tosamenfaat warrt. Kohlensüür warrt in de Twüschentiet ok synthiseert wenn afsluut keen Water dor is.
- Suboxiden as Trikohlenstoffdioxid (Malonsüüranhydrid, C3O2), Tetrakohlenstoffdioxid (C4O2), Pentakohlenstoffdioxid (C5O2), Oxalsüüranhydrid (C4O6) und Mellitsüüranhydrid (C12O9).
- Hydrogencarbonat oder Bicarbonaten (E+ HCO3-), wovun Natriumhydrogencarbonat dat bekanntste is, wat ok as Backdrievmiddel bruukt warrt.

- Carbonaten (E2+ CO32-) sünd de tweeweertigen Solten vun de Kohlensüür. De beiden bekanntsten Carbonaten sünd Natriumcarbonat, wat in de Ümgangsspraak ok as Soda betekent warrt un en wichtigen Grundstoff för’t Herstellen vun Glas is, un Calciumcarbonat, worut to’n Bispeel Musseln un Snecken jemehr Schalen opboet und dat vun Steenkorallen afscheedt warrt. Ut dat vun jem afscheedte oder dör annere Vörgäng över geoloogsche Tietduern billte Calciumcarbonat boet vundaag hele Bargen op. Butendem is Calciumcarbonat en wichtigen Bostoof.
- Kohlenstoff-Swevel-Verbinnen, wovun Kohlenstoffdisulfid (Swevelkohlenstoff, CS2), en bannig giftige Fletigkeit, de bekanntste Verbinnen is.
- Kohlenstoff-Stickstoff-Verbinnen as de Cyaniden. Dorvun is Kaliumcyanid (oder Zyankali) de bekanntste Verbinnen, wat ok düchtig giftig is, vun wegen, dat dat den Aten blockeert. Annere Cyaniden sünd tomeist jüst so giftig.
Borns
[ännern | Bornkood ännern]- ↑ M. A. Carpenter: Thermodynamics of phase transitions in minerals: a macroscopic approach. In: Stability of Minerals. Chapman & Hall, London 1992 oder E. Salje: Phase transitions in ferroelastic and coelastic Crystals. Cambridge University Press, Cambridge 1990
Literatur
[ännern | Bornkood ännern]- Holleman, Wiberg: Lehrbuch der Anorganischen Chemie. 101. Oplaag. De Gruyter, Berlin 1995, ISBN 3-11-012641-9
- State and Trends of the Carbon Market 2008 (PDF, 622kb, 78S.), The World Bank, Carbon Finance Unit, 7. Mai 2008
- Harry H. Binder: Lexikon der chemischen Elemente - das Periodensystem in Fakten, Zahlen und Daten. Hirzel, Stuttgart 1999, ISBN 3-7776-0736-3
Weblenken
[ännern | Bornkood ännern]- Kohlenstoff op Chemieseite.de (hoochdüütsch)
- Hybridiseeren vun Kohlenstoff (hoochdüütsch)
| H | He | ||||||||||||||||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||
| Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
| Alkalimetallen | Eerdalkalimetallen | Lanthanoiden | Actinoiden | Övergangssmetallen | Metallen | Halfmetallen | Nichmetallen | Halogenen | Edelgasen | Chemie unkünnig |

