Vanadium
| ||||||||||||||||||||||||||||||||||
| Allgemeen | ||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Naam, Teken, Atomtall | Vanadium, V, 23 | |||||||||||||||||||||||||||||||||
| Cheemsch Serie | Övergangselement | |||||||||||||||||||||||||||||||||
| Klöör | stahlgrau metallsch, bläulich | |||||||||||||||||||||||||||||||||
| Atommass | 50,9415 u | |||||||||||||||||||||||||||||||||
| Elektronenkonfiguratschoon | [Ar]3d34s2 | |||||||||||||||||||||||||||||||||
| Elektronen je Schaal | 2, 8, 11, 2 | |||||||||||||||||||||||||||||||||
| Physikaalsche Egenschoppen | ||||||||||||||||||||||||||||||||||
| Phaas | Faststoff | |||||||||||||||||||||||||||||||||
| Dicht | 6,11[1] g·cm−3 (bi RT) | |||||||||||||||||||||||||||||||||
| Smöltpunkt | 2183 K (1.910 °C) | |||||||||||||||||||||||||||||||||
| Kaakpunkt | 3680 K (3.407°C) | |||||||||||||||||||||||||||||||||
| Atomare Egenschoppen | ||||||||||||||||||||||||||||||||||
| Kristallstruktur | kubisch ruumzentreert | |||||||||||||||||||||||||||||||||
| Ionisatschoonsenergien | 1.: 650,9 kJ/mol | |||||||||||||||||||||||||||||||||
| 2.: 1414 kJ/mol | ||||||||||||||||||||||||||||||||||
| 3.: 2830 kJ/mol | ||||||||||||||||||||||||||||||||||
| Atomradius | 135 pm | |||||||||||||||||||||||||||||||||
| Annere Egenschoppen | ||||||||||||||||||||||||||||||||||
| Isotopen (Utwahl) | ||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||
Vanadium, fröher ok Vanadin, is en cheemsch Element mit dat Atomteken V un de Atomtall 23. Dat is en Övergangsmetall vun stahlgraue Klöör mit’n licht blauen Schimmer, dat in’n reinen Tostand bannig week is. In’t Periodensystem billt dat tosamen mit de Elementen Niob, Tantal un Dubnium de 5.Grupp oder Vanadiumgrupp. De gröttste Deel vun’t Vanadium warrt in as so nöömt Ferrovanadium in de Produkschoon vun Stahl insett. De Tosatz vun Vanadium in Chrom-Vanadium-Stahl maakt dat Material tager un dormit bestänniger.
Ok för vele Leevwesen is Vanadium vun grote bioloogsche Bedüden. To’n Bispeel speelt Vandium en grote Rull bi’t Stüern vun de Enzymen vun’t Phosphoryleeren un warrt vun Bakterien för’t Stickstofffixeeren bruukt.
De bekanntste Verbinnen vun’t Vanadium is Vanadium(V)-oxid, wat as Katalysater bi de Produkschoon vun Swevelsüür insett warrt.
Historie
[ännern | Bornkood ännern]
Dat Element Vanadium is 1801 to’n eersten mol vun den spaanschen Mineralogen Andrés Manuel del Río in en mexikaansch Blieierz, wat later den Naam Vanadinit kregen hett, opdeckt. Vunwegen de velen Klören vun de verschedenen Verbinnen hett he dat Element toeerst Panchromium nöömt, later Erythronium, vun wegen dat sik de Solten bivt ansüürn root farvt. Man, del Río hett sien Opdecken kort later wedder torüchtogen, as toeerst Alexander von Humboldt un later de franzöösche Chemiker H.V. Collett-Desotils seggen deen, dat he dat blot mit unrein Chrom to doon harr, vun wegen dat dat ne’e Element teemlich gliek weer[2].
Wedderopdeckt weer dat Element 1830 dör den sweedschen Chemiker Nils Gabriel Sefström. De hett Iesen ut de sweedschen Iesenierzkuhl Taberg ünnersöcht, dat he in Soltsüür löst harr. Dorbi hett he blangen annere bekannte Stoffen un unbekannt Element opdeckt, dat vele Egenschoppen jüst so as Chrom harr, bi annere Egenschoppen aver mehr den Uran gliek weer, opletzt aver keen vun de beiden weer. Dat ne’e Element hett he na Vanadis nöömt, dat is en Binaam vun de noordschen Göddin Freya. Korte Tiet later hett Friedrich Wöhler nawiest, dat Vanadium un Erythronium een un datsülve weern[3].
Metallsch Vanadium is to’n eersten mol 1867 vun Henry Enfield Roscoe dör Redukschoon vun Vanadium(II)-chlorid mit Waterstoff wunnen worrn. Vandium mit en Reinheit vun 99,7 % hebbt John Wesley Marden un Malcolm Rich 1925 as Eerste dör Redukschoon vun Vanadium(V)-oxid mit Calcium wunnen[4].
Bruukt weer dat element 1903 to’n eersten mol, as in England de eerste Stahl mit Vanadium herstellt weer. Vun 1905 af is de Bruuk in de Stahlindustrie düchtig stegen, as Henry Ford Vanadiumstahl to’n Bo vun Automobilen insetten de[5].
Vörkamen
[ännern | Bornkood ännern]
Dat Element Vanadium kummt op de Eer faken vör. Sien Andeel an de kontinentalen Eerdköst liggt bi ruchweg 120 ppm, wat en Elementmännichkeit is, de mit Zirkon, Chlor un Chrom to vergleken warrn kann. Gediegen kummt Vanadium aver nich vör, blots bunnen in verschedene Mineralen. Lagersteden mit hoge Kunzentratschonen vun Vanadium sünd aver roor, un dat gift vele Vanadiummineralen, de nich so faken to finnen sünd. In’n Vergliek to de Eerdkööst is de Vanadiumandeel in’t Seewater düütlich sieter. De liggt bi ruchweg 1,3 μg/l[6].
To de wichtigsten Vanadiummineralen tellt vör allen de Vanadaten as Vanadinit [Pb5(VO4)3Cl], Descloizit Pb(Zn, Cu) [OH|VO4] und Carnotit [K2(UO2)2(VO4)2·3H2O], as ok dat Vanadiumsulfit Patronit VS4. De gröttste Deel Vanadium kummt in Sporen in annere Mineralen vör, sünners in Iesenierzen as Magnetit. De Vanadiumandeel vun Tital-Magnetit-Ierzen liggt tomeist twüschen 0,3 un 0,8 %[7], kann aver in eenige süüdafrikaansche Ierzen bit to 1,7 %[5] groot wesen.

Ok Deerten un Planten bargt Vanadium. De Minsch wiest to’n Bispeel üm un bi 0,3 mg/kg op. Vör allen finnt sik dat Element in de Zellkarns oder in de Mitochondrien an. Welke Leevwesens, vör allen eenige Seeschedenorden un de Flegenpilz, sünd in de Laag, Vanadium antoriekern. In Seescheden is de Vanadiumandeel bit to 107 mol so groot as in’t Seewater ümto[8]. Dör den Vanadiumandeel vun Leevwesen bargt ok Kahl un Eerdööl Vanadium. Dor bedriggt de Andeel bit to 0,1 %[7]. Sünners hoge Andeelen sünd in Eerdööl ut Venezuela un Kanada to finnen[9].
In’t Johr 2006 weern tosamen 55.700 Tünnen Vanadiumierz afboet (rekent as Vanadiummetall). De wichtigsten Födderlänner sünd dorbi Süüdafrika, China un Russland. Knapp is de Rohstoff nich, as alltohopen Reserven vun 63 Miliionen Tünnen bekannt sünd[10].
Winnen un Dorstellen
[ännern | Bornkood ännern]
Dat Dorstellen vun Vanadium löpt över mehrere Schreed. Toeerst mutt ut de verschedenen Utgangsstoffen Vanadium(V)-oxid wunnen warrn. Dat kann to elementar Metall reduzeert un wenn nödig reinigt warrn.
Möögliche Utgangsstoffen, ut de Vanadium wunnen warrn kann, sünd Vanadiumierzen as Carnotit oder Patronit, Titan-Magnetit-Ierzen, de dat element bargt, un Eerdööl. Vanadiumierzen weern fröher för de Produkschoon wichtig, speelt hüüt aver keen bedüden Rull mehr. Se sünd vör allen dör de Titan-Magnetit-Ierzen aflöst worrn.
Wenn vanadiumbargen Iesenierzen in Hoochavens to Iesen reduzeert warrt, blifft dat Vanadium toeerst in’t Rohiesen torüch. Üm dat Rohiesen wieter to Stahl to verarbeiten, warrt bi’t Frischen Suerstoff inblaast. Dorbi geiht dat Vanadium in de Slack över, de bit to 25 % Vanadium(V)-oxid bargt un de wichtigste Born to’n Winnen vun dat Metall dorstellt. Üm dat reine Vanadium(V)-oxid to winnen, warrt de Slack fien mahlen un mit Natriumsolten as Natriumchlorid oder Natriumcarbonat to’n Oxideeren röst, wobi sik Natriummetavanadat billt. Dat löst sik in Water un warrt vun de Slack dör Utlaugen afscheedt. Dör Togaav vun Süür un Ammoniumsolten fallt Ammoniumpolyvanadat ut de Lösen ut, dat dör Rösten to Vanadium(V)-oxid ümwannelt warrt. Op den glieken Weg kann man ok ut annere Ierzen dat Oxid winnen, wenn dor Vanadium binnen is. Ut Eerdööl kann dat Vanadium dör Billn vun en Emulsion ünner Togaav vun Water un Magnesiumnitrat ruttogen warrn. Dat wietere Opbereiden löpt so af as bi’t Iesenierz[5].
Dat egentliche Winnen vun’t Vanadium passeert denn dör Redukschoon vun’t Oxid mit annere Metallen. As Redukschoonsmiddel künnt Aluminium, Calcium, Ferrosilizium oder Kohlenstoff bruukt warrn. Bi’t letzt billt sik bi de Reakschoon aver Carbiden, de vun’t Metall nich licht to scheden sünd
- Redukschoon mit Calcium
Wenn een rein Vanadium hebben will, warrt dat düre Calcium oder Aluminium as Redukschoonsmiddel tosett. Mit dat billige Ferrosilizium is en hoge Reinheit dorgegen nich hentokriegen. Wiel mit Calcium direkt rein Vanadium wunnen warrt, billt sik mit Aluminium toeerst en Aluminium-Vanadium-Legeren, ut de dör Sublimatschoon in’t Vakuum rein Vanadium wunnen warrt.
En groten Deel vun’t Vanadium warrt aver nich as rein Metall bruukt, man in Form vun de Iesen-Vanadium-Legeren Ferrovanadium, de tomindst 50 % Vanadium[5] bargt. För de Produkschoon is dat nich nödig, vörher dat reine Vanadium to tügen. An de Steed warrt de Slack mit dat Vanadium un dat Iesen dor binnen mit Ferrosilizium un Kalk to Ferrovnadium reduzeert. Disse Legeeren reckt för de meisten technischen Anwennen.
Hoochrein Vanadium kann elektrocheemsch oder na dat Van-Arkel-de-Boer-Verfohren dorstellt warrn. Dorto warrt dat reine Vanadium tosamen mit Jod in en luftleddige Glasampull insmölt. In de hitten Ampull billt sik Vanadium(III)-iodid, dat an en hitten Wolframdraht in hoochrein Vanadium un Jod verfallt.
- Reakschoon in’t Van-Arkel-de-Boer-Verfohren
Egenschoppen
[ännern | Bornkood ännern]physikaalsch
[ännern | Bornkood ännern]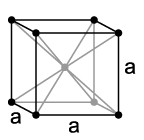
Vanadium is en taag, düütlich stahlblau Swoormetall, dat nich magneetsch is un smeedt warrn kann. De Dicht liggt bi 6,11 g/cm3[5]. Dat reine Vanadium is temmlich week, warrt aver dör Bimischen vun annere Elementen harder un wiest denn en hoge mechaansche Fastigkeit op. De meisten Egenschoppen sünd to verglieken mit de vun sien Naver in’t Periodensystem, dat Titan. De Smöltpunkt liggt bi 1910 °C, warrt aver dör Bimischen as Kohlenstoff düütlich höger. Bi en Andeel vun 10 % Kohlenstoff liggt de bi ruchweg 2700 °C[9]. Jüst so as Chrom oder Niob kristalliseert Vanadium in en kuubsch ruumzentreete Kristallstruktur mit de Ruumgrupp un den Gidderparameter a = 302,4 pm mit twee Formeleenheiten in een Elementarzell[11].
Ünner en Sprungtemperatur vun 5,13 K warrt Vanadium to’n Supraleider[12]. Jüst so as rein Vanadium warrt ok Legeren mit Gallium, Niob un Zirkon Supraleiders. Bi Temperaturen ünner 5,13 K wiest Vanadium – jüst as annere Metallen ut de Grupp as Niob un Tantal – in lütte Klutens bit 200 Atomen en spontane elektrische Polarisatschoon, de bit hüüt nich verkloort is un anners blots bi nich-metallsche Stoffen vörkummt[13][14].
cheemsch
[ännern | Bornkood ännern]Vanadium is as Metall nich eddel un kann mit vele Nichmetallen reageeren. An de Luft wohrt dat Metall wekenlang sien metallschen Gleem, över längere Tiet is düütlich en grönen Rust to sehn. Wenn Vanadium duersom kunserveert warrn schall, mutt dat ünner Argon lagert warrn. Bi Hitt un grote Warms warrt dat vun Suerstoff angrepen un oxdieert denn to Vanadium(V)-oxid. Mit Kohlenstoff un Stickstoff dorgegen reageert dat eerst bi Wittgloot, wiel Reakschonen mit de Halogenen Fluor un Chlor ok al bi siete Temperaturen aflopen künnt.
Gegen Süren un Basen is Vanadium bi Ruumtemperatur tomeist bestännig, vun wegen dat sik en dünne passiveeren Oxidschicht billt. Angrepen warrt dat blots vun Flusssüür un düchtig ocideeren Süren as hitte salpetersüür, kunzentreerte Swevelsüür oder Königswater.
Bit to en Temperatur vun 500 °C is Vanadium in de Laag Waterstoff to absorbeeren. Dorbi warrt dat Metall sprock un lett sik licht pulveriseeren. Bi 700 °C kann de Waterstoff in’t Vakuum wedder ruttogen warrn[5].
Isotopen
[ännern | Bornkood ännern]Vun Vanadium sünd vundaag tosamen 25 Isotopen un wietere 6 Karnisomeren bekannt[15]. Twee dorvun kamt in de Natur vör. Dat is tovn een 50V mit en natürlichen Andeel vun 0,25 % un to’n annern 51V mit en Männichkeit vun 99,75 %. 50V is swack radioaktiv un verfallt mit en Halfweertstiet vun 1,5 · 1017 Johren to 83 % dör Elektroneninfang to 50Ti un to 17 % dör β−-Verfall to 50Cr[15]. Beide Karns künnt för Ünnersöken mit de NMR-Spektroskopie nütt warrn.
Ünner de künstlichen Isotopen sünd 48V mit en Halfweertstiet vun 16 Daag un 49V mit en Halfweertstiet vun 330 Daag an’n bestännigsten. Se warrt as Tracer in de Nuklearmedizini insett[9]. All annern Isotopen un Karnisomeren sünd bannig unbestännig un verfallt in Minuuten oder Sekunnen.
Bruuk
[ännern | Bornkood ännern]

Rein Vanadium warrt blots to’n lütten Andeel as Hüllwarkstoff för Karnbrennstoffen bruukt vun wegen sien sieten Infangdweersnitt för Neutronen[16]. Man, ok bestännigere Vanadiumlegeren künnt bruukt warrn. Mehr as 90 % vun de Produkschoon warrt in en grote Tall vun Legeren insett, tomeist mit de Metallen Iesen, Titan, Nickel, Chrom, Aluminium oder Mangan. Blots ’n lütten Deel warrt in Verbinnen, vör allen as Vanadium(V)-oxid, bruukt.
De gröttste Deel (85 %) vun’t produzeerte Vanadium warrt in de Stahlindustrie bruukt. As Rohstoff deent hier Ferrovanadium, vun wegen dat hier keen hoge Reinheit nödig is. Al in lütte Mengden verbetert Vanadium da Fastigkeit un Taagheit vun Stahl un föddert dormit düütlich de Bestännigkeit gegen’t Afnütten. Dat kummt dör’t Entstahn vun hard Vanadiumcarbid. Je na Anwennen warrt ünnerscheedliche Mengden bimischt. To’n Bispeel bargt Bostahl un Warktüüchstahl blots lütte Mengden twüschen 0,1 un 0,5 %, wiel Gauarbeitsstahl dorgegen nit to5 % Vanadium bargt[7]. Vanadiumstahlen warrt vör allen för mechaansch belaste Warktüüch un Feddern insett. Wenn dor blangen Iesen un Vanadium ok Kobalt binnen is, warrt de Stahl megneetsch.
Titanlegeren, de Vanadium un tomeist ok Alauminium bargt, sünd sünners fast un bestännig gegen Hitt. Se warrt bi’n Flegerbo för drägen Deelen un Turbinenblööd vun Flegerdriefwarken insett[5].
In en Tyyp vun de so nöömten Redox-Flow-Zell deent Vanadium as Hööftelektrolyt. En Bispeel för so en Anwennen is de Vanadium-Redox-Akkumulater.
Nawies
[ännern | Bornkood ännern]En Vörproov gifft de Phosphorsoltperl, bi de Vanadium in de Redukschoonsflamm en tyypsch gröne Klöör maakt. De Oxidatschoonsflamm is dorgegen swack geel un dorüm nich goot nogg to kennen[17].
En qualitativen Nawies för Vanadium baseert op’t Billn vun Peroxovanadiumionen. Dorto warrt en sure Lösen, de Vanadium in de Oxidatschoonsstoop +5 bargt, mit wenig Waterstoffperoxid versett. Dorbi billt sik röötlich-brune [V(O2)]3+-kationen. De reageert mit gröttere Mengden Waterstoffperoxid to de swack gelen Peroxovanadiumsüür H3[VO2(O2)2][17].
Quantitativ kann Vanadium dör Titratschoon bestimmt warrn. Hierför warrt vanadiumbargen swevelsure Lösen mit Kaliumpermanganat to fiefweertig Vanadium oxideert un dorna mit en Iesen(II)-sulfat-Lösen un Diphenylamin as Indikater torüchtitreert. Ok en Redukschoon vun vörliggen fiefweertig Vanadium mit Iesen(II)-sulfat in’n veerweertigen Oxidatschoonstostand mit ansluten potentiometrische Titratschoon mit Kaliumpermanganatlösen is mööglich[5].
In de modernen Analytik kann Vanadium mit mehrere Methoden nawiest warrn. Dat sünd to’n Bispeel de Atomabsorpschoonsspektrometrie bi 318,5 nm oder de Spektralphotometrie mit N-Benzoyl-N-phenylhydroxylamin as Farvreagenz bi 546 nm[7].
Bioloogsche Bedüden
[ännern | Bornkood ännern]
Vanadiumverbinnen hebbt ünnerscheedliche bioloogsche Bedüden. Tyypsch für Vanadium is, dat dat anionisch as Vanadat vörkamen kann, man ok kationisch as VO2+, VO2+ oder V3+. Vanadaten sünd to verglieken mit Phosphaten un wirkt ok meist so. Vanadat binnt aver starker an egente Enzymen an as Phosphat un is dorüm in de Laag, Enzymen vun de Phosphoryleeren to besetten un op disse Oort to stüern. Dat bedröpt to’n Bispeel to Natrium-Kalium-ATPase, de den Transport vun Natrium un Kalium in de Zellen stüert. Dat Blockeeren kann mit Desferrioxamin B gau wedder oplöst warrn, vun wegen dat dat mit Vanadat en bestännigen Kuimplex billt[6].
Wieter hett Vanadium ok Utwirken op de Glukoosopnahm. Dat Element is in de Laag, in de Lebber de Glykolys antoregen un den Konkurrenzvörgang vun de Glukoneogenees to törnen. Dat föhrt to’n Afsacken vun’n Glukoos-Spegel in’t Blood[7]. Dorüm warrt ünnersöcht, wat Vandiumverbinnen för’t Behanneln vun Diabetes mellitus Tyyp 2 dögen deit. Opstunns sünd aver noch keen eendüdigen Resultaten funnen worrn[18]. Bito regt Vanadium ok de Oxidatschoon vun Phospholipiden an un hinnert de Synthees vun Cholesterin dör’t Törnen vun de Squalen-Sythaas – dat is en mikrosomal Enzymsystem vun de Lebber. Dat bedüüt op de annern Siet, dat en Mangel an Vanadium en högere Kunzentratschoon vun Cholesterin un Triglyceriden in’t Bloodplasma utlösen deit[19].
Bi Planten speelt Vanadium en Rull bi de Photosynthees, vun wegen dat dat de Reakschoon to’n Billn vun 5-Aminolävulinsüür ahn Enzym katalyseeren kann. Dat is en wichtige Vörstoop to’n Billn vun’t Chlorophyll[6].
Welke Organismen bargt Enzymen, in de Vanadium binnen is, as to’n Bispeel eenige Bakterienorden, de vaandiumbargen Nitrogenasen to’n Stickstofffixeeren hebbt. Dat sünd ü.a. Orden vun’t Geslecht Azozobacter as ok dat Cyanobakterium Anabaena variabilis[6]. Disse Nitrogenasen hebbt aver nich dat Vermögen as de Molybdän-Nitrogenasen, de veel fakener vörkamt, un warrt dorüm eerst bi Molybdänmangel aktiveert[20]. Wietere Enzymen mit Vanadium finnt sik in Bruunalgen un Flechten. Disse hebt Haloperoxidasen, de Vanadium bargt, mit de se Chlor-, Brom- oder Jod-orgaansche Verbinnen opboet.
Welke Seescheden bargt Vanadium in grote Mengden as Vanabinen, dat sünd en Oort vun Metallproteinen. De Funkschoon vun dat Vanadium dor binnen is aver noch nich kloor. Man hett inst glöövt, dat dat Element as Suerstofftransporter deent, jüst so as dat Hämoglobin, man dat hett sik as verkehrt rutstellt[20].
Gefohren
[ännern | Bornkood ännern]Jüst so as annere Metallstoffen, kann ok Vanadiumstoff oder -pulver tünnern. In Deerversöken is nawiest worrn, dat Vanadium un sien anorgaanschen Verbinnen karzinogen sünd. Se warrt dorüm in de Kanzerogenitäts-Kategorie 2 inordent[21]. Wenn Vanadiumstoff över längere Tiet inatent warrt, to’n Bispeel vun Arbeiters bi’t Metallverhütten, kann sik en Vanadismus billn. Dat is en Beroopskrankheit, de sik dör angrepene Sliemhüüt, gröönswarte Verfarven vun de Tung as ok dör duersome Bronchial-, Lungen- un Darmkrankheiten wiesen kann[7].
Cheemsch Verbinnen
[ännern | Bornkood ännern]
In Verbinnen kann Vanadium verschedene Oxidatschoonsstopen annehmen. Faken sünd de Stopen +5, +4, +3 un +2, roor de Stopen +1, 0, -1 un -3. De bestännigsten un wichtigsten Oxidatschoonsstopen sünd +5 un +4.
Waterige Lösen
[ännern | Bornkood ännern]In waterige Lösen kann Vanadium licht in annere Oxidatschoonsstopen bröcht warrn. Dorbi gifft dat Farvännern, vun wegen dat verschedene Vanadiumionen tyypsche Klören opwiest.
In sure Lösen billt fiefweertig Vanadium VO2+-Ionen ahn Klöör, de bi de Redukschoon toeerst to veerweertige VO2+-Ionen wannelt warrt. De dreeweertige Stoop mit V3+-Ionen hett en gröne Klöör, de deepste Stoop, de in waterige Lösen to kroegen is, is dat tweeweertige V2+-Ion mit en grauvigelette Klöör.
Suerstoffverbinnen
[ännern | Bornkood ännern]
De bedüdenste un bestännigste Vandiumverbinnen mit Suerstoff is dat Vanadium(V)-oxid V2O5. Disse Verbinnen hett en oraansche Klöör un warrt in gröttere Mengden as Katalysater bi de Produkschoon vun Swevelsüür bruukt. Se hett dorbi de Funkschoon, Suerstoff to överdrägen un warrt bi de Reakschoon to en anner’t Oxid, neemlich Vanadium(IV)-oxid VO2 reduzeert. Annere bekannte Vanadiumoxiden sünd Vanadium(III)-oxid V2O3 und Vanadium(II)-oxid VO.
In alkaalsche Lösen billt Vanadium(V)-oxid Vanadaten, also Solten mit dat Anion VO43−. In’n Gegensatz to de analogen Phosphaten is dat Vanadat aver de bestännigste Form. Hydrogen- un Dihydrogenvanadaten as ok de fre’e Vanadiumsüür sünd nich bestännig un blots in dünne waterige Lösen bekannt. Wenn Vanadatlösen ansüürt warrt, billt sik an Steed vun Hydrogenvanadaten de Polyvanadaten, in de sik bit to teihn Vanadateenheiten tosamenlagert. Vanadaten sünd in verschedene Mineralen to finnen, as to’n Bispeel in Vanadinit, Descloizit un Carnotit.
Halogenverbinnen
[ännern | Bornkood ännern]
Mit den Halogenen Fluor, Chlor, Brom un Jod geiht Vanadium en grote Tall vun Verbinnen in. In de Oxidatschoonsstoop +5 is blots een Verbinnen, dat Vanadium(V)-fluorid bekannt. In de Stopen +4, +3 un +2 gifft dat Verbinnen mit all Halogenen, alleen mit Jod gifft dat blots Verbinnen mit de Stopen +2 un +3. Vun technische Bedüden sünd vun disse Verbinnen blots de Chloriden Vanadium(IV)-chlorid un Vanadium(III)-chlorid. Se warrt ünner annern as Katalysaters för de Produkschoon vun Ethylen-Propylen-Dien-Kautschuk insett[5].
Vanadiumoxidchloriden
[ännern | Bornkood ännern]De so nöömten Vanadiumoxidchloriden sünd Mischsolten mit Suerstoff un Chlor. Vanadium(III)-oxidchlorid, VOCl, is en geelbruun Pulver, dat sik in Water löst. Dat Vanadium(IV)-oxidchlorid, VOCl2, besteiht ut gröne, hygroskoopsche Kristalltafeln, de sik in Water mit blaue Klöör löst. Insett warrt dat in de Fotografie un as Textilbeize.Vanadium(V)-oxidchlorid, VOCl3, opletzt is en gele Fletigkeit, de dör Water licht hydrolyseert warrt. VOCl3 deent as Katalysaterkomponent bi de Nedderdruckethenpolymerisatschoon[22].
Annere Vanadiumverbinnen
[ännern | Bornkood ännern]Sien sietsten Oxidatschoonsstopen 0, -1 un -3 hett Vandium in orgaansche Verbinnen. Vun Bedüden sünd hier vör allen de Metallocenen, de so nöömten Vanadocenen. Se warrt as Katalysater för de Polymerisatschoon vun Alkinen bruukt[23].
Vanadiumcarbid VC warrt as Pulver ünner annern to’n Plasmasprütten oder Plasma-Pulver-Opdragsschweißen insett[24] . Butendem warrt Vanadiumcarbid bi Hardmetallen tosett, üm dat Koornwassdom lütter to maken[5]. Dorbi entstaht de so nöömten Cermets, de sünners hard un bestännig gegen Afnütten sünd.
Borns
[ännern | Bornkood ännern]- ↑ N. N. Greenwood un A. Earnshaw: Chemie der Elemente, 1. Oplaag, 1988, S. 1260, ISBN 3-527-26169-9
- ↑ L. R. Caswell: Andres del Rio, Alexander von Humboldt, and the Twice-Discovered Element. In: Bull. Hist. Chem.. 2003, 28 (1), S. 35–41.
- ↑ N. G. Sefstöm: Über das Vanadin, ein neues Metall, gefunden im Stangeneisen von Eckersholm, einer Eisenhütte, die ihr Erz von Taberg in Småland bezieht. In: Annal. d. Physik, 1831, 97 (1), S. 1–4.
- ↑ Vanadium. In: Encyclopædia Britannica. 2008. Encyclopædia Britannica Online, afropen an’n 6. Oktober 2008 (online).
- ↑ a b c d e f g h i j Günter Bauer et. al.: Vanadium and Vanadium Compounds. In: Ullmann’s Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim 2000, DOI 10.1002/14356007.a27_367.
- ↑ a b c d Dieter Rehder: Bioanorganische Chemie des Vanadiums In: Angew. Chem., 1991, 103, S. 152–172.
- ↑ a b c d e f Vanadium in: Roempp Chemie Lexikon, Thieme Verlag, 2008.
- ↑ Holleman/Wiberg, 102. Oplaag, S. 1542.
- ↑ a b c Holleman/Wiberg, 102. Oplaag, S. 1543.
- ↑ U.S. Geological Survey: Vanadium, Mineral Commodity Summaries, January 2008.
- ↑ K. Schubert: Ein Modell für die Kristallstrukturen der chemischen Elemente. In: Acta Crystallographica 1974, 30, S. 193–204, DOI 10.1107/S0567740874002469.
- ↑ Aaron Waxler, William S. Corack: Superconductivity of Vanadium. In: Physical Review, 1952, 85, (1), S. 85–90, DOI 10.1103/PhysRev.85.85.
- ↑ T. Kromme: Metalle auf Abwegen. Über das ungewöhnliche Tieftemperaturverhalten winziger Metallklumpen. In Spektrumdirekt.de vom 22. Mai 2003.
- ↑ Science 300: S. 1265–1269 (2003).
- ↑ a b G. Audi, O. Bersillon, J. Blachot, A. H. Wapstra: The NUBASE evaluation of nuclear and decay properties, in: Nuclear Physics, 2003, Bd. A 729, S. 3–128.
- ↑ Wissenschaft-Online-Lexika: Eintrag zu Vanadium, in: Lexikon der Physik; abgerufen 9. Juli 2008.
- ↑ a b Jander, Blasius, Strähle: Einführung in das anorganisch-chemische Praktikum, 14. Auflage, S. Hirzel Verlag, Stuttgart 1995, S. 218–219, ISBN 978-3-7776-0672-9.
- ↑ D.M. Smith, R.M. Pickering and G.T. Lewith: A systematic review of vanadium oral supplements for glycaemic control in type 2 diabetes mellitus.. In: QJM: An International Journal of Medicine, 2008, 101, (5), S. 351–358, DOI 10.1093/qjmed/hcn003.
- ↑ Wissenschaft-Online-Lexika: Indrag to Vanadium, in: Lexikon der Biologie; afropen an’n 9. Juli 2008.
- ↑ a b Wolfgang Kaim, Brigitte Schwederski: Bioanorganische Chemie, 4. Oplaag, Teubner, Wiesbaden 2005, S. 241–243, ISBN 3-519-33505-0.
- ↑ Presseverkloren vun de DFG to Ännern in de List vun de MAK- un BET-Werten, 19. Juli 2005.
- ↑ Wissenschaft-Online-Lexika: Indrag to Vanadiumoxidchloride. In: Lexikon der Chemie; afropen an’n 9. Juli 2008.
- ↑ Vanadium-organische Verbindungen. In: Roempp Chemie Lexikon, Thieme Verlag, 2008.
- ↑ Bruuk vun Vanadiumcarbid vun de H. C. Starck-Gruppe.
Literatur
[ännern | Bornkood ännern]- Günter Bauer et. al.: Vanadium and Vanadium Compounds. In: Ullmann’s Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim 2000, DOI: 10.1002/14356007.a27_367.
- Norman N. Greenwood, Alan Earnshaw: Chemie der Elemente, 1. Oplaag, Wiley-VCH, Weinheim 1988, ISBN 3-527-26169-9.
- Arnold F. Holleman, Nils Wiberg: Lehrbuch der Anorganischen Chemie, 102. Oplaag, de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1.
- Vanadium in: Roempp Chemie Lexikon, Thieme Verlag, 2008.
Weblenken
[ännern | Bornkood ännern]- EnvironmentalChemistry.com – Vanadium (engelsch)
| H | He | ||||||||||||||||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||
| Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
| Alkalimetallen | Eerdalkalimetallen | Lanthanoiden | Actinoiden | Övergangssmetallen | Metallen | Halfmetallen | Nichmetallen | Halogenen | Edelgasen | Chemie unkünnig |




