Alkan

De Alkanen (fröher: Grenzkohlenwaterstoffen oder Paraffinen) sünd in de orgaanschen Chemie de Stoffgrupp vun de sättigten, azyklischen Kohlenwaterstoffen, de eenzig ut de beiden Elementen Kohlenstoff (C) un Waterstoff (H) opboet sünd. Se künnt mit de allgemenen Summenformel CnH2n+2 mit n = 1, 2, 3, ... schreven warrn[1][2].
De Grundstruktur vun de Alkanen kann ut nich-vertwiegte aver ok ut vertwiegte Kohlenstoffkeden bestahn. Verbinnen ahn Twiegen warrt as n-Alkanen betekent un billt en homologe Reeg vun de Alkanen. De Verbinnen mit Twiegen warrt dorgegen Isoalkanen oder i-Alkanen nöömt.
Sättigte zyklische Kohlenwaterstoffen hebbt en annere allgemene Summenformel un billt dorüm en egene Stoffgrupp, de as Zykloalkanen betekent warrt.
n-Alkanen
[ännern | Bornkood ännern]Dat eenfackste Alkan besteiht ut een eenzig Kohlenstoffatom, dat mit veer Waterstoffatomen verbunnen is un heet Methan. De nafolgen Tabell wiest de eersten twölf n-Alkanen ut de homologen Reeg vun de Alkanen:
| C | Naam | Summenformel | Flammpunkt | Smöltpunkt | Kaakpunkt | Dicht | Kugel-Staff-Modell |
|---|---|---|---|---|---|---|---|
| 1 | Methan | CH4 | – | 90,65 K | 111,4 K | 0,667 kg/m³ |  |
| 2 | Ethan | C2H6 | – | 90 K | 185 K | 1,212 kg/m³ |  |
| 3 | Propan | C3H8 | – | 85 K | 231 K | 1,83 kg/m³ |  |
| 4 | n-Butan | C4H10 | – | 135 K | 272,5 K | 2,703 kg/m³ | |
| 5 | n-Pentan | C5H12 | 224 K | 144 K | 309 K | 0,626 g/cm³ | |
| 6 | n-Hexan | C6H14 | 250 K | 178 K | 342 K | 0,659 g/cm³ | |
| 7 | n-Heptan | C7H16 | 269 K | 182 K | 371 K | 0,684 g/cm³ | |
| 8 | n-Octan | C8H18 | 289 K | 216 K | 399 K | 0,718 g/cm³ |  |
| 9 | n-Nonan | C9H20 | 304 K | 222 K | 424 K | 0,733 g/cm³ |  |
| 10 | n-Decan | C10H22 | 319 K | 243 K | 447 K | – | |
| 11 | n-Undecan | C11H24 | – | – | – | – | |
| 12 | n-Dodecan | C12H26 | – | – | – | – |  |
i-Alkanen
[ännern | Bornkood ännern]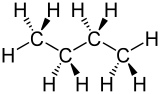
|
|
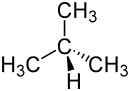
| n-Butan | iso-Butan (2-Methylpropan) |
Mit tonehmen Tall vun Kohlenstoffatomen in en Verbinnen stiggt ok de Tall vun de Mööglichkeiten för jemehr kovalente Verknütten. Alkanen höger as Propan kamt dorüm in en Veeltall vun Konstitutschoonsisomeren vör – dat sünd Molekülen, de de glieke Summenformel hebbt, sik aver in’n Opbo (Konstitutschoon) ünnerscheedt.
Dat eerste Alkan, dat as Isomer vörkamen kann, is dat Butan, dat bi de glieken Summenformel C4H10 twee ünnerscheedliche Strukturen opwiesen kann (kiek ok op’t Bild). Butan gifft dat also in twee ünnerscheedliche Konstitutschonen: n-Butan un iso-Butan.
| Naam | Tall vun de Konstitutschoons-isomeren | Tall vun de Konstitutschoons-isomeren un Konfiguratschoons-isomeren |
| Methan | 1 | 1 |
| Ethan | 1 | 1 |
| Propan | 1 | 1 |
| Butan | 2 | 2 |
| Pentan | 3 | 3 |
| Hexan | 5 | 5 |
| Heptan | 9 | 11 |
| Octan | 18 | 24 |
| Nonan | 35 | 55 |
| Decan | 75 | 136 |
Vun’t Pentan gifft dat al dree verschedene Konstitutschonen: dat n-Pentan mit en Keed, de nich vertwiegt is, dat iso-Pentan mit en Twieg an’t tweete Kohlenstoffatom un dat neo-Pentan mit twee Twiegen an’t tweete Kohlenstoffatom.
Mit gröttere Tall vun Kohlenstoffatomen stiggt ok de Tall vun de mööglichen Isomeren bannig an, vun de dat aver de meisten blots theoreetsch gifft. In Natur un Technik hebbt blots en poor wenige dorvun en gröttere Bedüden. De Tabell gifft en Överblick över de theoreetsche Tall vun möögliche Konstitutschoonsisomeren för de eersten teihn Alkanen (ahn de Stereoisomeren, de af Heptan vörkamen künnt).
Ikosan (ehmols Eikosan) mit en Keed ut twintig Kohlenstoffatomen hett all 366.319 verschedene Konstitutschoonsisomeren. Bi Alkanen mit 167 Kohlenstoffatomen liggt de Tall vun de theoreetsch mööglichen Isomeren över de schätzte Tall vun de Deelken, de in’t sichtbore Universum vörkamt.
Stereochemie vun de Alkanen
[ännern | Bornkood ännern]Vertwiegte Alkanen künnt, as to’n Bispeel dat 3-Methylhexan un sien högeren Homologen, dör dat Stereozentrum an’t Kohlenstoff op Positschoon 3 chiral wesen. Alkanen, de op disse Oort vertwiegt sünd, hebbt in Biomolekülen en wichtige Funkschoon. So is de Sietenkeed vun’t Chlorophyll as ok de vun’t Tocopherol (Vitamin E) en vertwiegt Alkan un somit chiral. Chirale Alkanen künnt dör enantioselektive Gaschromatografie in jemehr Enantiomeren splitt warrn[3].
Nomenklatur
[ännern | Bornkood ännern]
De Nomenklatur vun de Alkanen is dör de IUPAC nipp un nau fastleggt.
All Stammnaams höört mit -an op. Vör disse Ennen steiht dat greeksche Tallwoort, dat de Tall vun de Kohlenstoffatomen angifft. För de eersten veer Alkanen warrt an de Steed vun disse Regel de Trivialnaams Methan, Ethan, Propan und Butan bruukt, de sik histoorsch dörsett hebbt.
För de Alkanen mit Twiegen gellt de nafolgen Regeln för de Naams:
- De Kohlenstoffatomen vun de längsten Kohlenstoffkeed in’t Molekül warrt so dörnummereert, dat de tertiären oder quartären Kohlenstoffatomen en mööglichst siete Tall afkriegt. Dat is denn de Fall, wenn de Summ vun all disse Tallen mööglichst lütt warrt (för’t Bispeelmolekül in’t Bild: 2+3+4=9). De Stammnaam vun’t Molekül richt sik na dissen längsten Keed (för’t Bispeelmolekül: 6 Kohlenstoffatomen → Hexan)
- De Naams vun de aftwiegen Sietenkeden (Alkylgruppen) warrt ok na jemehr Läng bestimmt un in alphabeetsche Reeg na den Stammnaam vun’t Alkan vöranstellt (kiek ok Tosatzregel a). De Sietenkeden kriegt de Ennen -yl (kiek ok Alkylrest).
- De Alkylgruppennaams warrt dör Binnstreken scheedt de Nummern vun de Kohlenstoffatomen vörstellt, an de se bunnen sünd (kiek ok Tosatzregel b).
- Tosatzregel a) Twiegt mehr as een Alkylgrupp mit glieken Naam vun de Hööftkeed af, warrt dissen Alkylgruppennaam de Tall in de greekschen Schrievwies (twee = di, dree = tri, veer = tetra usw.) as Tallwoort vöranstellt. Wohrschau: disse Tallwöör speelt keen Rull för de alphabeetsche Reeg.
- Tosatzregel b) Gifft dat mehrere aftwiegen Alkylgruppen mit glieken Naam, warrt de Tallen vun de KOhelnstoffatomen mit Kommas scheedt. Wenn twee glieke Alkylgruppen an en quartär Kohlenstoffatom bunnen sünd, denn warrt de Tall vun’t Kohlenstoffatom dubbelt opschreven.
En Bispeel för de Tosatzregeln a) un b) is dat 3-Ethyl-2,2,4-trimethylhexan. In’n Ünnerscheed to dat 3-Ethyl-2,4-dimethylhexan baven in’t Bild weer dorbi an Steed vun dat Waterstoffatom an’t tweete Kohelnstoffatom en wietere Methylgrupp bunnen.
Fröher weern Alkanen as „Grenzkohlenwaterstoffen“ oder Paraffinen betekent. „Paraffin“ kummt vun’t latiensche parum affinis, wat mit „wenig verwandt“ översett warrn kann. Man hett neemlich fröher dacht, dat Stoffen, de mitenanner reageert, en Oort vun „Verwandschop“ opwiesen müssen, un wies mit de Beteken dorophen, dat se teemlich reakschoonstraag sünd. Vundaag warrt de Naam meist bloots noch för en Stoffmischen ut sünnere faste Alkanen bruukt.
Alkylrest
[ännern | Bornkood ännern]Wenn ut en Alkanmolekül en Waterstoffatom ruttogen warrt, entsteiht en Radikal, also en Molekül mit en Elektron, wat nich bunnen is. Man seggt dorto Alkylradikal. Den Naam vun dissen Alkylrest billt man, wenn man bi de Ennen vun’t Alkan dat -an dör en -yl uttuuscht. In Formel warrt Alkylen faken mit R („Rest“) opschreven. Gifft dat ünnerscheedliche Alkylresten, warrt dat as R1, R2, R3 verkloort. Alkanen kann man ok as dimeriseerte Alkylen opfaten.
Molekülgeometrie
[ännern | Bornkood ännern]-
sp³-Hybridiseeren bi Methan.
-
Tetraederstruktur vun Methan.
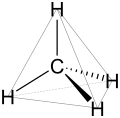
De rüümliche Struktur vun de Alkanen speelt n grote Rull för de physikaalschen un cheemschen Egenschoppen. Üm dat to verstahn, mutt een sik de Elektronenkonfiguratschoon vun’n ankieken. Kohlenstoffatomen hebbt in’n Grundtostand veer fre’e Elektronen, de so nöömten Valenzelektronen, de för Binnen un Reakschonen bruukt warrt. In en Kohlenstoffatom, dat nich bunnen is, bewegt sik disse veer Elektronen in Orbitalen mit ünnerscheedliche Energiestopen. Man, in de Alkanen is dat Atom jümmer sp³-hybridisiert, wat so veel bedüüt, as dat sik de veer Orbitalen (en s-Orbital un dree p-Orbitalen) överlagert un veer ne’e Orbitalen billt, de all de glieke Energie hebbt. In’n Ruum ordent de sik in de Form vun en Tetraeder an, so dat de Winkel twüschen de Orbitalen 109,47° bedriggt.
Läng un Winkel vun de Binnen
[ännern | Bornkood ännern]In en Alkanmolekül gifft dat blots Binnen twüschen C-H un C-C (Kohlenstoffeenfackbinnen). De eerste Oort kummt dör Överlagern vun en sp³-Hybridorbital vun’n Kohlenstoff mit dat 1s-Orbital vun’n Waterstoff tostannen, de annere dör Överlagern vun twee sp³-Hybridorbitalen vun twee Kohlenstoffatomen.
-
Binnlängen un -winkels vun’t Methanmolekül
-
Binnlängen un -winkels vun’t Ethanmolekül
De Binnläng bedriggt 109 Pikometer för de C-H-Binnen un 154 Pikometer för de C-C-Binnen, dat heet de Afstand is twüschen de Kohlenstoffatomen üm ruchweg 50 % grötter as twüschen en Kohlenstoff- un en Waterstoffatom. Dat kummt vör allen dör de ünnerscheedlichen Atomradien.
De rüümliche Anorden vun de Binnen folgt ut’t Utrichten vun de veer sp³-Orbitalen vun’n Kohlenstoff. As de tetraedrisch anordent sünd, sünd dat ok de C-C- und de C-H-Binnen, so dat ok twüschen jem en fasten Winkel vun 109,47° liggt. De Strukturformel, bi de de Binnen vun de Molekülen normalerwies as lieke Streken dorstellt waart, gifft de rüümliche Struktur also an sik verkehrt wedder.
Konformatschoon vun de Alkanen
[ännern | Bornkood ännern]Dat Weten üm de Strukturformel un de Binnwinkels leggt den rüümlichen Opbo vun’t Molekül tomeist noch nich vullstännig fast. To’n Bispeel gifft dat för jede C-C-Binnen en wieteren Freeheitsgrad: den Winkel, den de an de beiden Binnatomen bunnen dree Atomen oder Atomgruppen toenanner innehmen doot. De rüümliche Anorden, de dör dissen Winkel beschreven warrt, warrt as Konformatschooon vun’t Molekül betekent.
Ethan
[ännern | Bornkood ännern]
De eenfachste Fall bi de Alkanen is dat Ethan. Hier gifft dat nipp un nau een C-C-Binnen. Wenn een op de Ass kiekt, de dör disse Binnen defineert is, kriggt man de so nöömte Newman-Projekschoon: Een Kohlenstoffatom is in de Projekschoon mit sien dree Waterstoffatomen in’n Vördergrund to sehn, dat annere warrt dör en Krink afdeckt un liggt na de Definitschoon in’n Achtergrund. In’t Diagramm sünd sien Binnen to de dree Waterstoffatomen also blots deelwies to sehn. De vörderen as ok de achteren dree Waterstoffatomen nehmt in de Projekschoon en Winkel vun 120° toenanner in, as dat ok för de Projekschoon vun en Tetraeder op en Flach gellen deit. Nich fastleggt is aver de Winkel θ twüschen de beiden Gruppen vun Waterstoffatomen. Dat beschrifft in’t Ethan-Molekül de Konformatschoon.
De Konformatschoonswinkel kann jeden Weert twüschen 0° un 360° annehmen, man qualitativ sünd blots twee verschedene Konformatschonen intressant:
- In de ekliptischen Konformatschoon is de Konformatschoonswinkel 0°, 120° oder 240°, so dat jümmer en Waterstoffatom vun vörn un een vun achtern tohopenfallt.
- In de staffelten Konformatschoon is de Konformatschoonswinkel 60°, 180° oder 300°, so dat in de Projekschoon jümmer en Waterstoffatom vun achtern twüschen twee vördere liggt.
De beiden Konformatschonen, ok Rotameren nöömt, ünnerscheedt sik in jemehr Energie, de in dissen Fall as Torsionsenergie betekent warrt, üm ruchweg 12,6 kJ/mol. Wiel de ekliptische Konformatschoon de Energie gröttst mööglich maakt un dorüm unbestännig is, warrt se in de staffelte Konformatschoon an sietsten un is energeetsch dorüm beter. All annere Konformatschonen leegt dortwüschen. De Oorsaak vun dissen Energieünnerscheed is noch nich vullstännig kloor. Bi de ekliptischen Konformatschoon is de Afstand twüschen de C-H-Binnelektronen vun’t vördere un achtere Kohlenstoffatom lütter, dat elektrostaatsche Afstöten twüschen jem is grötter un dormit ok de Energie. Anners rüm gifft de staffelte Konformatschoon Ruum för en starkere Delokalisatschoon vun de Binnelektronen. Dat is en quantenmechaanschen Effekt, de de Struktur bestännig maakt un de Energie rünnersett. Disse Versöök, dat to verkloren gellt vundaag as wohrschienlich.
De Torsionsenergie vun’t Ethanmolekül is bi Ruumtemperatur lütt gegenöver de thermischen Energie, wat to en anduern Rotatschoon üm de C-C-Ass föhrt. Aver in regelmatige Tietrüüm „rast“ dat Molekül in de staffelten Konformatschoon „in“, so dat sik to jede Tiet ruchweg 99 % vun de Molekülen in de Neeg vun’t Energieminimum befinnt. De Övergang twüschen twee naverte staffelte Konformatschonen duert aver in’n Dörsnitt blots 10−11Sekunnen.
Högere Alkanen
[ännern | Bornkood ännern]
För de beiden C-C-Binnen in’t Propanmolekül gellt qualitativ datsülve as för’t Ethan, man bi Butan un högere Alkanen sütt dat kumplizeerter ut.
Wenn een sik de middlere Binnen vun’t Butanmolekül ankieken deit, so is jeed Kohlenstoffatom dorvun an twee Waterstoffatomen un een Methylgrupp bunnen. Bi de Newmanprojekschoon is to sehn, dat sik veer qualitativ ünnerscheedliche Rotameren ünnerscheden laat, twüschen de dat ok wedder all mööglichen Twüschentostännen gifft. Jüst as bi’t Ethan hebbt de Konformatschonen mit de lüttsten oder gröttsten Energie to doon.
- Wenn in de Projekschoon beide Methylgruppen an de glieken Steed leegt, also bi en Torsionswinkel vun 0°, warrt vun en vull-ekliptischen oder synperiplanaren Konformatschoon snackt. Se stellt dat globale Maximum vun de Torsionsenergie dor, vun wegen dat de Waterstoffatomen vun de Methylgruppen so dicht bi’nanner to liggen kamt, dat sik jemehr Elektronenwulken afstöten doot.
- Bi en Torsionswinkel vun 60° oder 300° warrt de Konformatschoon as scheevstaffelt oder synklinar betekent. Anners as bi de ekliptischen Strukturen leegt hier all Atomen oder Atomgruppen vun’t vördere Kohlenstoffatom in de Projekschoon twüschen de vun dat achtere Kohlenstoffatom. Dordör gifft sik hier en Minimum vun de Energie. Man, wegen de Neeg vun de beiden Methylgruppen to’nanner is dat Minimum blots lokal, d. h. dat gifft noch en Konformatschoon, de energeetsch noch beter is.
- Wenn de Torsionswinkel 120° oder 240° is, is de Konformatschoon partiell-ekliptisch. Ut de glieken Grünnen as bi’t Ethan is disse Struktur energeetsch nich günstig. Anners as bi de vull-ekliptischen Konformatschoon leegt de beiden Methylgruppen aver nich to dicht, so dat de Energie blots öörtlich an’n gröttsten warrt.
- Bi en Torsionswinkel vun 180° is de Konformatschoon antiperiplanar. As bi de staffelten Konformatschoon bi’t Ethan, kummt dat hier to en quantenmechaansch begrünnte starkere Delokalisatschoon vun de Elektronen, wiel de Methylgruppen togliek den gröttstmööglichen Afstand to’nanner hebbt. In dissen Tostand is de Energie also global an’n lüttsten.
De Energieafstand twüschen de syn- un de antiperiplanaren Konformatschoon bedriggt ruchweg 19 kJ/mol un is also bi Ruumtemperatur jümmer noch lütt gegenöver de thermischen Energie. Dreihbewegen üm de middlere C-C-Ass sünd dorüm jümmer noch licht mööglich. As bi’t Ethan is aver de Wohrschinelichkeit dorför, dat en Molekül en sünnern Tostand annehmen deit, nich gliek groot. För de antiperiplanare Konformatschoon is se üm un bi dubbelt so groot as för de synklinale, wiel de beiden ekliptischen Tostännen so goot as gor nich vörkamen doot.
Bi de högeren Alkanen is dat Bild vun’t Prinzip her dat glieke. För all C-C-Binnen is jümmer de antiperiplanare Konformatschoon, bi de de anbunnen Alkylgruppen den gröttsmööglichsten Afstännen vun’nanner hebbt, de energeetsch günstigste un warrt dorüm an wohrschienlichsten innahmen. Ut dissen Grund warrt de Alkanen tomeist in en Zickzack-Anorden dorstellt, as dat ok baven in de Tabell to sehn is. De wohre Struktur is bi Ruumtemperatur jümmer ’n beten anners as in disse idealiseerte Konformatschoon. Dat heet, de Alkanmolekülen hebbt keen faste staffordige Form, as dat Modell dat wiesen deit.
Annere Kohlenwaterstoffmolekülen as to’n Bispeel de Alkenen boet op dise Grundstruktur op, sünd aver dör Dubbelbinnen stedenwies stiever, wat to’n duersom Verbögen föhren kann.
Egenschoppen
[ännern | Bornkood ännern]De Alkanen billt en Stoffgrupp, de sünners eenheitlich is. Dat reckt, de Egenschoppen vun en poor Stoffen vun de Stoffgrupp to kennen, üm dat Verhollen vun de annern vörruttoseggen. Dat gellt för de Wesselwirken twüschen de Molekülen vun de Alkanen, de sik op den Smöltpunkt und den Kaakpunkt utwirkten doot, aver jüst so ok för jemehr Synthees un Reakschonen.
Physikaalsche Egenschoppen
[ännern | Bornkood ännern]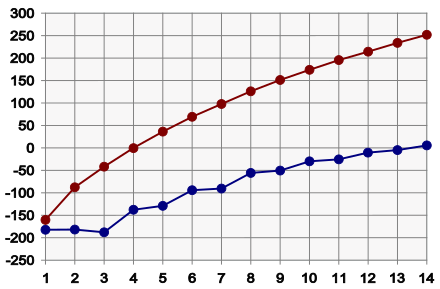
De Molekülstruktur, vör allen de Grött vun de Böverflach vun de Molekülen, leggt den Kaakpunkt vun en Stoff fast: je lütter de Flach, ümso sieter is sien Kaakpunkt, vun wegen dat de Van-der-Wals-Kräft, de twüschen de Molekülen wirkt, lütter sünd. Dat de Böverflach lütter warrt, kanndorbi dör Vertwiegen oder dör en Ringstruktur tostannen kamen. Dat heet praktisch, dat Alkanen mit en högeren Kohlenstoffandeel normalerwies en högeren Kaakpunkt opwiest als Alkanen mit lütteren Kohlenstoffandeel. Vertwiegte Alkanen hebbt dorbi en sieteren Kaakpunkt as nich vertwiegte un ringförmige hebbt en sieteren Kaakpunkt as de vertwiegten. Vun fief Kohlenstoffatomen an sünd nich vertwiegte Alkanen ünner Normalbedingen fletig, vun söventeihn an sünd se fast. De Kaakpunkt stiggt för jede CH2-Grupp üm 20-30 °C an.
Ok de Smöltpunkt vun de Alkanen stiggt – mit’n eenzige Utnahm bi Propan – bi antiegen Tall vun de Kohlenstoffatomen, man de Smöltpunkten stiegt sünners bi de högeren Alkanen langsamer an as jemehr Kaakpunkten[4]. Butendem stiggt de Smöltpunkt vun Alkanen mit ungraaden Kohelsntofftallen to Alkanen mit graade Kohlenstofftall starker an as annersrüm. De Oorsaak för dit Phänomen is de gröttere Packdicht vun de Alkanen mit graadtallige Kohlenstofftall. De Smöltpunkt vun de vertwiegten Alkanen kann höger oder sieter liggen as de Weert vun dat tohören nich vertwiegte Alkan. Je sparriger dat Molekül is, ümso sworer lett sik de Stoff drang packen, so dat sien Smöltpunkt ok sieter liggt. Annersrüm gifft dat en Reeg vun Isoalkanen, de en düütlich drangere Struktur annehmt as de tohören n-Alkanen. In den Fall leegt de Smöltpunkten höger as de vun de graadlienten Isomeren.
Alkanen künnt keen elektrischen Stroom leiden un laat sik ok nich duersom elektrisch polariseren. Ut den Grund billt se keen Waterstoffbrüchenbinnen ut un laat sik in polare Löösmiddels as Water blots bannig slecht lösen. As de Waterstoffbrüchenbinnen vun de enkelten Watermolekülen in de Neeg vun’t Alkan dorvun weg wiest un dorüm nich isotrop utricht sünd, d. h. se wiest nich all gliekmatig in een Richt, weer in Mischen vun de beiden Stoffen mit en Tonahm an molakulare Ornen verbunnen. Na den tweeten Hööftsatz vun de Thermodynamik is dat aver verboden, un so billt sik bi’n Versöök de beiden to mischen jümmer twee afsett Schichten ut. Alkanen warrt dorüm as waterafwiesen oder hydrophob betekent. In nich-polare Löösmiddels künnt Alkanen dorgegen goot lööst warrn, wat in de Fackspraak as lipophil betekent warrt. Ünnerenanner künnt se to’n Bispeel bi glieke Phaas in jede Proportschoon mischt warrn.
Bit op en poor Utnahmen warrt de Dicht vun de Alkanen mit tonehmen Tall vun Kohlenstoffatomen grötter. Vun wegen dat se sieter liggt as bi Water, swemmt Alkanen bi’n Versöök vun Mischen jümmer baven. Wenn fletige Alkanen brennen doot, künnt se dorüm nich mit Water löscht warrn.
Cheemsch Egenschoppen
[ännern | Bornkood ännern]In’n Grundsatz reageert de Alkanen eher traag, vun wegen dat jemehr C-C- un C-H-Binnen teemlich bestännig sünd un nich eenfach optobreken sünd. Anners as de meisten annern orgaanschen verbinnen, hebbt se ok keen funkschonelle Gruppen.
Mit ionischen oder allgemeen mit polare Stoffen reageert se bannig slecht. Jemehr pKs-Weerten leegt bi all Alkanen över sösstig. mit normale Süren un Basen reageert se dorüm praktisch gor nich. Dorop wiest ok al de Trivialnaam Paraffin hen (lat.: parum affinis = „wenig toneegt“). In’t Eerdööl to’n Bispeel sünd de Alkanmolekülen al siet Millionen vun Johren cheemsch nich mehr ännert worrn.
Alkanen gaht aver Redoxreakschonen in, vör allen mit Suerstoff un mit de Halogenen, vun wegen dat sik jemehr Kohlenstoffatomen in en bannig reduzeerten Tostand befinnen doot. In’n Fall vun Methan hett de Kohelnstoof sogor de sietste Oxidatschoonstall -IV, de bi Kohlenstoff mööglich is. In’n eersten Fall hannelt sik dat üm Verbrennen, in’n tweeten üm Substitutschoonsreakschonen.
Radikalen, also Molekülen mit unpaarte Elektronen, speelt bi de meisten Reakschonen en grote Rull, so ok bi’t „Cracken“ un bi’t Reformeeren, wobi de Alkanen mit lange Keden in welke mit korte Keden oder nichvertwiegte in vertwiegte ümwannelt warrt.
Bi düchtig vertwiegte Molekülen gifft dat en Afwieken vun’n idealen Binnwinkel, de dordör tostannen kummt, dat de Alkylgruppen an de verschedenen Kohlenstoffatomen, rüümlich anners to dicht bi’nanner liggen deen. Dör de „Spannung“ hiervun, de ok as stersche Spannung betekent warrt, reageert disse Molekülen veel duller.
Reakschonen
[ännern | Bornkood ännern]mit Suerstoff
[ännern | Bornkood ännern]All Alkanen reageert mit Suerstoff, sünd also brennbor, man se sünd nich brandföddern. Mit tonehmen Tall vun de Kohlenstoffatomen stiggt de Flammpunkt an. In’n Vergliek to annere Kohlenwaterstoffen as de Alkenenen oder Alkinen reageert se ünner Freesetten vun’n gröttsten Deel vun jemehr Energie. Woll sett en Dubbel- oder Dreefackbinnen mehr Energie free as en Eenfackbinnen, man dör de gröttere Tall an oxideerbore Watestoffatomen in’t Molekül (6 bi Ethan, 4 bi Ethen un 2 bi Ethin) mehr as kompenseert. De Standardbrennenthaltpien leegt ruchweg bi de folgen Weerten:
Also warrt bi’t Verbrennen vun’t Ethan de meiste Energie freesett (negative Enthalpie). Wenn noog Suerstoff toföhrt warrt, verbrennt Alkanen mit swack lüchten Flamm, de keen Sott afgifft.
Cheemsch is de Reakschoon mit Suestoff en Redoxreakschoon, bi de de Alkanen oxideert un de Suerstoff reduzeert warrt. Bi’t vullstännige Verbrennen reageert de Kohlenstoff to Kohlenstoffdioxid (Oxidatschoonstall +IV) un de Waterstoff to Water, dat in Form vun Damp freesett warrt.
De afsluute Verbrennenergie stiggt vergliekswies regelmatig mit tonehmen Tall vun Kohlenstoffatomen. Jede CH2-Grupp stüert üm un bi 650 kJ/mol bi. Vun wegen dat de Brennenergie bi de vertwiegten Alkanen wat sieter is as bi de nich-verwtiegten, kann een seggen, dat de vertwiegten ’n beten wat bestänniger sünd.
Wenn Alkanen nich vullstännig verbrennt warrt, vun wegen dat to wenig Suerstoff dor is, warrt Nevenprodukten free as Kohlenstoff, Alkenen oder Kohlenstoffmonoxid. De Energiebüüt is denn ok lütter, dorüm is en vullstännig Verbrennen vun de Alkanen wichtig. En Bispeel för en nich vullstännige Verbrennen is de folgen Reakschoon:
- Oktan reageert mit Suerstoff zo Kohlenstoffdioxid, Kohlenstoffmonoxid, Kohlenstoff (Sott), Propen un Water.
Wenn sik bi’t Verbrennen vun Benzin swarten Rook billt, düüt dat dorop hen, dat nich noog Suerstoff toföhrt warrt.
mit Halogenen
[ännern | Bornkood ännern]En wietere Reakschoonsgrupp mit grote Bedüden sünd de Halogeneerreakschonen. Ok de höört to de groten Grupp vun de Redoxreakschonen, vun wegen dat sik de Oxidatschoonstallen vun de bedrapen Kohlenstoffatomen ännert.
Bi’t Halogeneeren warrt de Waterstoffatomen vun en Alkan deelwies oder vullstännig dör Halogenatomen as Fluor, Chlor oder Brom uttuuscht, d. h. substitueert. Dorüm warrt dorbi ok vun en Substitutschoonsreakschoon snackt. Bi de Reakschoon entstaht de so nöömten Halogenalkanen, meist in Mischen, as dat nafolgen Bispeel för Methan wiest:
- Methan reageert mit Chlor to Mono-, Di-, Tri- un Tetrachlormethan as ok to Chlorwaterstoff.
De Proportschoon vun de enkelten Halogenalkanen hangt af vun de Reakschoonsbedingen un den Reakschoonsverloop. In de Reakschoonsglieken is de free wählt un kann ok ganz anners utsehn.
De Reakschoon mit Chlor finnt al bi siete Energie statt, as to’n Bispeel ünner ultravigelett Licht. De hoge Büüt vun de Reakschoon op en Energieeenheit wiest dorop hen, dat dorbi en Kedenreakschoon aflöpt. Dorbi warrt in’n Reakschoonsverloop jümmer wedder Halogenradikalen billt, wenn sik eerst eenmol een to anfang billt hett. Dat holt so lang vör, bit de Överschuss an Halogenatomen afboet is.
Bi jede Kedenreakschoon lööpt de Halogeneeren in dree Schreden af:
- Initieeren: De tweeatomigen Halogenmolekülen warrt to’n Bispeel dör energieriek Licht homolytisch, also bi symmetrische Opdeelen vun de Elektronen, in Radikalen opsplitt:
- Propageeren, Schritt 1: En Halogenradikal löst en Waterstoffatom ut en Alkanmolekül rut un lett en Alkylradikal torüch:
- Propageeren, Schritt 2: En Alkylradikal lööst ut en Halogenmolekül en Halogenatom rut un lett en Halogenradikal torüch:
Disse beiden Schreden wesselt sik bi de Reakschoon jümmer wedder af, ut de wenigen Halogenradikalen to Anfang warrt so jümmer mehr Reakschoonsprodukten.
- Termineeren: De Reakschoon höört op, wenn de Wohrschienlichkeit, dat twee Radikalen openanner draapt, grötter warrt as de op en nich oder noch nich vullstännig halogeneert Alkan to drapen. In den Fall kummt dat to en Rekombinatschoon:
Ofschoonst ok bi de letzten vun disse Slussreakschonen to Helogenalkanen föhrt, is jemehr Tall so lütt, dat se gegen de Tall vun de Atomen, de bi de Kedenreakschoon billt warrt, keen Rull speelt.
Bit hier is noch nix dorto seggt worrn, wovun Waterstoffatom bi en vörgeven Alkan toeerst subtitueert warrt. Bi de wichtigsten Fäll vun’t Methan un Ethan stellt sik disse Fraag ok nich, vun wegen dat all Waterstoffatomen gliek sünd. Bi de högeren Alkanen sünd aver eenige vun jem an sekundäre un annere an tertiäre Kohlenstoffatomen bunnen. Disse Binnen sünd swacker, wat sik bi’t Halogeneeren dordör wiest, dat toeerst disse Waterstoffatomen gegen Halogenatomen uttuuscht warrt (Markownikow-Regel).
Bispeel: 2-Chlorpropan CH3–CHCl–CH3 gifft dat in’n Vergliek to 1-Chlorpropan CH2Cl–CH2–CH3 as Reakschoonsprodukt fakener, as dat na de Statistik antonehmen weer.
Dat Reakschoonsvermögen is för de veer Halogenen bannig ünnerscheedlich. Bi 27 °C bedriggt de Proportschoon
F : Cl : Br : I = 140.000 : 1300 : 9 · 10–8 : 2 · 10−19.
Dorut lett sik al de ünnerscheedliche Verloop vun de Reakschonen aflesen: De Reakschoon vun Alkanen mit Fluor lett sik kuum stüern, löpt mit Chlor langsom, mit Brom blots swack un blots ünner Lichtinwirken, mit Jod dorgegen meist gor nicht.
Dat Jodeeren is energeetsch sogor ungünstig. Dorüm warrt Jod bi Halogeneerreakschonen as Radikalfanger insett, üm de Kedenreakschoon aftobreken. Dör Anhollen vun de Substitutschoonsreakschoon kann se deelwies stüert warrn, üm de Büüt vun en sünnert Reakschoonsprodukt grötter to maken.
Vun technische Bedüden sünd vör allen chloreerte un fluoreerte Methangasen. De Reakschoon dormit kann aver to en Explosion föhren. Trichlormethan weer fröher ünner den Naam Chloroform as Narkoosmiddel insett. Fluor-Chlor-Kohlenwaterstoffen weern lange Tiet as Driefgas bruukt. As kloor worrn is, dat se Schaden an de Ozonschicht vun de Eer maken doot, hebbt se an Bedüden verloren.
Cheemsch nawiesen kann een Halogenalkanen mit Help vun de Beilsteinproov.
Cracken un Reformeeren
[ännern | Bornkood ännern]Dat Cracken un dat Reformeeren sünd wichtige Reakschonen bi’t Opbereiden vun Rohööl.
Bi de eersten Reakschoon warrt ünner hogen Druck un hoge Temperatur ut högere Alkanen de sieteren Alkanen wunnen, de veel bedüdener sünd. To’n Opsplitten vun de C-C-Binnen kummt dat dorbi an Katalysaters as ü.a. Aluminium. Bispeel:
- Dodekan splitt sik in en Dekyl- un en Ethyl-Radikal.
Dör Rekombinatschoon sett sik de wedder to ne’e Alkanen tosamen. Bispeel:
- En Ethyl- un en Propylradikal reageert to Pentan.
Dör de Wahl vun de Reakschoonsbedingen kann een sekerstellen, dat ut disse Reakschonen vör allen Alkanmolekülen mit korte Keden tostannenkamt. Op densülven Weg kann een ok Nevenreakschonen hinnern, de nich wünscht sünd, as to’n Bispeel dat Billn vun Alkenen. Tomeist warrt bi’t Cracken ok noch Waterstoff tosett, üm Verunreinigungen as Swevel oder Stickstoff wegtomaken. In den Fall warrt ok vun Hydrocracking snackt.
Dat Reformeeren is dorgegen nödig bi Alkanmischen, de as Benzin insett warrn schüllt. Dorto warrt n-Alkanen, de för dissen Bruuk nich so go’e Egenschoppen opwiest, an Katalysaters in vertwiegte Alkanen un in Arenen, also aromaatsche Kohlenwaterstoffen ümwannelt.
Annere Reakschonen
[ännern | Bornkood ännern]Mit Help vun Nickel-Katalysators kann ut Alkanen bi en Reakschoon mit Waterdamp Waterstoff wunnen warrn. Wietere Reakschonen vun de Alkanen sünd de Sulfochloreeren un en Reakschoon mit Salpetersüür, de Nitreeren, de aver beid sünnere Bedingen bruukt. En veel gröttere technische Bedüden hett aver de Fermentatschoon to Alkansüren.
Gefahren
[ännern | Bornkood ännern]Methan kann vun en Luftvolumenandeel vun een bit acht Prozent vun sülvst, also ahn Tünnerer, explodeeren un is butendem en stark Driefhuusgas. Ok eenige annere siete Alkanen künnt in süneere Volumenandeelen mit Luft mischt vun sülvst tünnern. Vun wegen jemehr Brennborkeit künnt Alkanen en Gefahr dorstellen. Mit stiegen Kohlenstoffandeel stiggt aver ok de Flammpunkt. Propan, Butan, Pentan, Hean, Heptan un Oktan, as ok eenige wietere Alkanen sünd Gefahrstoffen, man jemehr MAK-Weerten sünd teemlich hooch ansett. För Pentan liggt de to’n Bispeel bi 2950 mg/m³, för Hexan bi blots 180 mg/m³. Pentan, Hexan, Heptan un Oktan sünd butendem ok ümweltgefährlich, wiel högere Alkanen tomeist blots noch as reizend instopt warrt oder gor keen Gefahrstoffen mehr sünd
Dorstellen
[ännern | Bornkood ännern]De Alkanen, de en lütte Tall vun Kohlenstoffatomen bargt, künnt ut de Elementen sülvst maakt warrn. Högere Alkanen mööt na dat Bergius-Verfohren ünner hogen Druck produzeert warrn. Eenige vun de Reakschonen hebbt en egenen Naam kregen.
Dat Dorstellen vun Alkanen kann op ünnerscheedliche Orden paseeren:
- över katalytisch Hydreeren vun Alkenen, as na
- Ethen un Waterstoff reageert to Ethan.
- Dorstellen ut Halogenalkanen mit Help vun Waterstoff. To’n Bispeel:
- Tetrachlormethan reageert mit Waterstoff to Chlorwaterstoff un Methan
- över de Kolbe-Elektrolyys. Dorbi warrt Alkancarboxylaten to Radikalen reduzeert, dat ünner Afgaav vun Kohlenstoffdioxid in Alkyresten verfallt. De dimeriseert to Alkanen.
- över de Wurtzsche Synthees, bi de ünner Billn vun Metallhalegoniden ut Halogenalkanen un Metallorganylen Alkanen entstaht. De allgemene Reakschoonsglieken is:
- över dat Bergius-Verfohren, bi dat de Produkschoon vun Alkanen ünner hogen Druck un Temperatur ut Kahl un Waterstoff vör sik geiht.
- över’t Fischer-Tropsch-Verfohren, bi dat fletige Alkanen ut Kohlenstoffmonoxid un Waterstoff gerstellt warrt. Bispeel:
- Kohlenstoffmonoxid reageert mit Waterstoff to Methan un Water.
In’t Johr 1985 is een vun längsten Alkanen dorstellt worrn, de jemols künstlich maakt worrn sünd. Dat weer tohopensett ut Molekülen mit en Kedenläng vun nipp un nau 390 Kohlenstoffatomen.
Vörkamen
[ännern | Bornkood ännern]
Alkanen gifft dat op de Eer as ok in’t Sünnsystem, man blots de eersten hunnert un de meisten dorvun ok blots in Sporen. Gröttere Bedüden hebbt op anere Himmelskörpers vör allen de lichten Kohlenwaterstoffen. In’n Steert vun den Komet Hyakutake aver ok in eenige Meteoriten, de so nöömten kohligen Chondriten, sünd de beiden Gasen Methan un Ethan nawiest worrn. Se billt butendem ok en wichtigen Andeel an de Atmosphären vun de buteren Gasplaneten Jupiter, Saturn, Uranus un Neptun. Op den Saturnmaand Titan weern lange Tiet sogor grote Seen ut sietere un högere Alkanen vermoodt. Aver vundaag geiht man dorvun ut, dat dat bestenfalls en poor lüttere Seen ut Ethan gifft. Ok bi’n Mars sünd Sporen vun Methan in de Atmosphäär opdeckt worrn. Dat is opstunns de gröttste Henwies dorop, dat op den Planet Leevwesen (Boddenbakterien) togang wesen heben künnt.
In de Atmosphäär vun de Eer kummt Methan in Sporen vör. De Andeel bedriggt blots ruchweg 0,0001 % oder 1 ppm. Tüggt warrt dat Gas vör allen vun de bakterienordigen Archaeen. In de Ozeanen kummt Alkanen so giott as gor nicht vör, vun wegen dat se sik nich in Water löst. Man, ünner hogen Druck un bi siete Temperatur in Wateries infroren, kann man Methan as so nöömt Methanhydrat finnen. Ofschoonst dat bit vundaag nich kommerziell afboet warrn kann, liggt de Brennweert vun de bekannten Methanhydratfeller över de Energie vun all Eerdgas- un Eerdööllagers op de Eer tosamen üm en Mehrfack. Methanhydrat gellt dorüm as en Energiedräger för tokamen Tieten.

Vundaag sünd de wichtigsten kommerziellen Borns för Alkanen aver ahn Twievel dat [[[Eerdgas]] un das Eerdööl, de as eenzige orgaansche Verbinnen mineraalsch in de Natur vörkamt. Eerdgas besteiht vör allen ut de lichten Methan un Ethan mit Bimischen vun Propan un Butan. Eerdööl betsieht dorgegen ut en Mischen vun fletige Alkanen un annere Kohlenwaterstoffen. Beids is entstahn, as dode Seedeerten ünner Afsluss vun Suerstoff vun Sedimenten todeckt un in’n Verloop vun vele MIllionen Johren bi hoge Temperaturen un ünner hogen Druck to de Naturstoffen ümwannelt worrn sünd. Eerdgas entsteiht dorbi to’n Bispeel dör de folgen Reakschoon:
- Druvensucker reageert ünner hogen Druck un Temperatur to Methan un Kohlenstoffdioxid.
Se hebbt sik denn in poröse Stenen ansammelt, de na baven vun Schichten afdicht weern, wo dat Ööl oder dat Gas nich dör künn. Anners as Methan, dat in grote Mengden jümmer wedder nee billt warrt, billt sik de högeren Alkanen in de Natur nich in gröttere Mengden nee. In en poor Johrteihnten geiht dat mit den Vörraat dorvun to Enn.
Faste Alkanen kamt vör as Rüchstand vun verdunst Eerdööl, dat in de Böverflach kamen is, dat so nöömte Eerdwass. Een vun de gröttsten Vörkamen vun faste Alkanen gifft dat in’n so nöömten Asphaltsee vun La Brea op dat Karibik-Eiland Trinidad.
Verarbeiten un Bruuk
[ännern | Bornkood ännern]
Alkanen hebbt en grote weertschoppliche Bedüden. To’n een sünd se de Grundstoffen vun de cheemschen Industrie, wo se to Kunststoffen wieterverarbeit warrt, to’n annern stellt se de wichtigsten Brennstoffen vun de hüütigen Tiet dor.
Grundlaag vun’t Verarbeiten sünd jümmer Eerdgas un Eerdööl. Dat Eerdöl warrt in en Eerdöölraffinerie dör frakschoneerte Destillatschoon opsplitt un denn to vele annere wichtige Produkten as to’n Bispeel Benzin wieterverarbeit. Dorbi warrt utnütt, dat de enkelten Andelen vun’t Rohööl ünnerscheedliche Kaakpunkten hebbt un dorüm licht vunennanner scheedt warrn künnt. Man, binnen de Frakschonen leegt de Kaakpunkten dicht bi’nanner.
Woto en Alkan bruukt warrt, lett sik teemlich goot an de Tall vun de Kohlenstoffatomen fastmaken. De Afgrenzen is dorbi aver eher groff un gellt nich streng. De eersten veer Alkanan warrt vör allen to’n Heizen un Kaaken bruukt. Methan un Ethan sünd de Hööftbestanddeelen vun’t Eerdgas. Se warrt normalerwies ünner Druck in de Gasphaas lagert. För den Transport is dat aver günstiger, dat Gas in de fletige Phaas to bringen. Dorto mutt dat ünner hogen Druck tosamendrückt warrn.
Propan und Butan künnt dorgegen al bi teemlich sieten Durck fletig maakt warrn un warrt dorüm in Fletiggas insett, dat as Driefstoff bruukt warrt – as Autogas in Brennmotoren oder in de Bueree to’n Andrieven vun Treckers. Propan warrt wieter ok in Propangasbrenners bruukt. Butan warrt veel as Füertüüchgas insett. Wenn de Fletigkeit, de ünner lichten Druck steiht, utströömt, geiht se in das Gasphaas över mit lütte Drapens dorin un lett sik so licht tünnern. Butendem warrt de beiden Gasen ok as Driefgas in Spraydosen bruukt.
Pentan bit Oktan sünd Fletigkeiten, de licht verdunsten doot. Se döögt dorüm goot as Brennstoff in normale Brennmotoren, vun wegen dat se in de Brennkamer licht in’t gasförmigen Tostand wesselt un dor keen Drapens billt, wat de Gliekmatigkeit vun’t Verbrennen stören de. In’n Driefstoff schüllt blots vertwiegte Alkanen rin, vun wegen dat se nich de Negen hebbt, fröh to tünnern, as de n-Alkanen. En Maat för’t Fröhtünnern is de so nöömte Oktantall. Se gifft an, wo dull en Brennstoff to’n fröhtünnern neegt. As Betogsgrött för de Ontaktall sünd de beiden Alkanen n-Heptan un iso-Oktan (2,2,4-Trimethylpentan) wählt worrn. Heptan tünnert meist fröh un hett de Oktantall 0, wiel iso-Oktan dat kuum maken deit un dorüm de Oktantall 100 hett. De Oktantall vun en Driefstoff seggt, wovun Mischproportschoon vun iso-Oktan un n-Heptan an’n besten de Kloppegenschoppen angifft. Blangen jemehr Funkschoon as Brennstoffen warrt de middleren Alkanen ok as go’e Löösmiddels för nich-polare Stoffen bruukt.
Alkanen vun Nonan bit ruchweg to’n Hexadekan sünd Fletigkeiten mit teemlich hoge Viskosität, d. h. se sünd taagfletig un egent sik dorüm mit tonehmen Tall vun Kohlenstoffatomen jümmer weniger för normal Benzin. So billt dorför de Hööftbestanddelen vun Dieselkraftstoff un Kerosin (Flaagbenzin). De Funkschoonswies vun en Dieselmotor oder vun en Turbien is en annere as de vun’n Otto-Motor. Vun dorher speelt de Viskosität hier keen Rull. Man, bi deepe Temperaturen kann Dieselkraftstoff aver wegen den hogen Andeel vun langkedige Alkanen verklamen. Dat is en Problem, dat vör allen in kolle Rebeden in de Neeg vun de Polen vörkummt. Wieter is disse Frakschoon ok Bestanddeel vun’t Petroleum un weer fröher för Petroleumlampen bruukt.
Alkanen, de höger as dat Hexadekan sünd, billt wichtige Bestanddeelen vun’t Heizööl un vun’t Smeerööl. In disse Funkschoon wirkt se togliek ok as Korrosionsschuulmiddel, vun wegen dat jemehr hydrophobe Egenschop Water vun de Deelen afholl, de anners rusten künnen. Vele faste Alkanen warrt för Paraffinwass bruukt, worut to’n Bispeel Kersen maakt warrt. Dat is aver nich to verwesseln mit echt Wass, dat vör allen ut Estern besteiht.
Alkanen mit Kedenlängen vun 35 un mehr warrt in’n Asphalt mischt un dormit as Stratenbelag insett. Alltosamen hebbt de högeren Alkanen aver keen grote Bedüden un warrt dorüm tomeist dör Cracken in sietere Alkanen opsplitt
Alkanen in de lebennigen Natur
[ännern | Bornkood ännern]In de Natur kamt Alkanen op veele verschedene Wiesen vör, tellt liekers aver bioloogsch nich to de essentiellen Stoffen.
Alkanen bi Bakterien un Archaeen
[ännern | Bornkood ännern]
Sünnere Bakterienorden sett Alkanen in jemehrn Stoffwessel üm. Dorbi warrt Kohlenstoffkeden mit gerade Tallen lever ümsett, vun wegen dat se beter aftoboen sünd, as welke mit ungerade Tallen.
Annersrüm produzeert eenige Archaeen, de so nöömten Methanbillners, Methan in grote Mengden ut Kohlenstoffdioxid. De dorför nödige Energie kriegt se dör Oxidatschoon vun molekularen Waterstoff:
- Kohlendioxid reageert mit Waterstoff to Methan un Water.
Methanbillner tüügt ok dat Sumpgas, dat in Sümp un Moorrebeden freesett warrt un op glieke Wies ok in de Fueltoorns vun Kloorwarken tostannenkummt. Se sett jeed Johr ruchweg 2 Milliarden Tünnen Methan free, so dat de Andeel in de Atmosphäär meist blots vun de Archaeen kummt. Ok dat Methan, dat vun Plantenfreters utstött warrt, de Zelluloos verdaut (Rindveeh künnt dorvun jeden Dag bit to 150 Liter freesetten), bit hen to de Termiten, geiht dat opletzt allns op de Methanbillners torüch. In vergliekswies lütte Mengden tüügt se ok in’n Darm vun de Minschen Methan. Methanbilln Archaeen speelt also en grote Rull in’n Kohlenstoffkreisloop, vun wegen dat se photosyntheetsch bunnen Kohlenstoff wedder in de Atmosphäär torüchbringt. De hüütigen Eerdgaslagersteden sünd wohrschienlich ok to’n groten Deel vun disse Leevwesens tüügt worrn.
Alkanen bi Planten un Poggenstöhl
[ännern | Bornkood ännern]Ok bi de dree eukaryootschen Hööftgruppen vun de Leevwesens, de Poggenstöhl, Planten un Deerten speelt Alkanen en Rull, wenn ok keen grote. Bi de eersten Grupp kamt vör allen de flüchtigen sieten Alkanen vör, neemlich in de Sporen. Eenige sünnere Gesten, de Alkangesten, nütt Alkanen as Energie- un Kohlenstoffborn. De Kerosinpoggenstohl (Amorphotheca resinae) bruukt för sien Stoffwessel an’n leefsten Flaagbenzin ut langkedige n-Alkanen.
Bi de Planten finnt sik blangen orgaansche Stoffen, de vertwiegte, zyklische, nich-sättigte un Heterokomponenten bargt, vör allen de langkedigen fasten Alkanen wedder. Tosamen mit annere Verbinnen billt se bi meist all Planten en faste Wassschicht, de de an de Luft freeliggen Butenhuut, de Cuticula, bedecken deit. So schuult se gegen Utdrögen, gegen dat Utwaschen vun wichtige Mineralen dör Regen un nich toletzt ok gegen Bakterien, Poggenstöhl un Schaadinsekten, de mit jemehr Benen faken in de wassordige Schicht insacken doot un dordör bi’t Lopen hinnert warrt. Ok de gleemen Schicht Op Aaft un Frücht as Appel bestaht ut langkedige Alkanen. De Kohlenstoffkeden hebbt dorbi meist twüschen twintig un veertig Atomen un kamt ut Alkansüren tostannen wiel de Wassdomsphass vun de Planten. AS de Alkansüren ut C2-Eenheiten opboet warrt (Zitratzyklus) un Alkanen dör Verleren vun de Carboxyl-Grupp – d. h. dör Decarboxyleeren – billt warrt, wiest de Alkanen in Blattwass vun de högeren Landplanten vör allen Kohlenstofftallen mit ungerade Tall op. Woans dat Wass nipp un nau tosamen sett is, hangt nich blots vun de Plantenoort af, man ok vun de Johrestiet un vun annere Ümweltfakters as De Lichtbedingen, Temperatur oder de Luftfuchtigkeit. Man weet vundaag aver, dat vör allen Grääs, an’n düütlichsten Grääs ut de Tropischen un subtropischen Vegetatschoonsrebeden (in Steppen un Savannen), in’n Vergliek to de Bööm un Strüker in de Regel ’n beten wat längere Kohlenstoffkeden opwiesen doot. Wetenschopplers nütt dissen Ümstand in de Nehrmiddelforschung vun Herbivoren ut, jüst so as Klimaforschers to’n Beoordeelen vun de klimaafhangigen Grasverdelen op de Eer in de geoloogschen verleden Tiet.
Alkanen bi Deerten
[ännern | Bornkood ännern]Bi Deerten kamt Alkanen in öölbargen geweev vör, speelt dor aver in’n Gegensatz to de nichsättigten Kohlenwaterstoffen keen grote Rull. En Bispeel is de Hailebber, ut de een Ööl winnen kann, dat to ruchweg 14 % ut Pristan besteiht, dat is en Alkan mit de Strukturbeteken 2,6,10,14-Tetramethylpentadekan (C19H40). Wichtiger sünd Alkanen in de Pheromonen, cheemsche Bodenstoffen, op de vör allen Insekten för jemehr Kommunikatschoon anwiest sünd. Bi eenige Orden as den Buckkäver Xylotrechus colonus, de vör allen n-Pentakosan (C25H52), 3-Methylpentakosan (C26H54) und 9-Methylpentakosan (C26H54) produzeert, warrt se dör Liefkuntakt överdragen, so dat hier vun Kuntaktpheromonen snackt warrt. Ok bi annere Orden as bi de Tse-Tse-Fleeg Glossina morsitans morsitans, bi de de Pheromonen vör allen ut de veer Alkanen 2-Methylheptadekan (C18H38), 17,21-Dimethylheptatriakontan (C39H80), 15,19-Dimethylheptatriakontan (C39H80) und 15,19,23-Trimethylheptatriakontan (C40H82) besteiht, wirkt de Stoffen över den Liefkuntakt[5] un deent vör allen as Sexuallockstoff. Disse Ümstand warrt bi’t Bekämpen vun den Krankmaker utnütt.
Annere ökoloogsche Utwirken
[ännern | Bornkood ännern]
En Bispeel, bi dat de Bruuk vun Alkanen in Platen un bi Deerten in Rull speelt, is de ökoloogsche Wesselrelatschoon twüschen de Andrena nigroaenea, de to de Sandimmen (Andrena) höört, un de Orchideen-Oort Grote Spinnen-Orchis. De Plant is op dat Bestöven dör de Imm anwiest. Aver ok de Sandimmen bruukt Pheromonen to’n Söken vun Partners. In’n Fall vun de Andrena nigroaenea sett de Seken en Mischen in, dat ut Trikosan (C23H48), Pentakosan (C25H52) un Heptakosan (C27H56) in de Proportschoon 3:3:1 besteiht. De Heken warrt dör dissen tyypschen Röökstoff anlockt. De Orchidee nütt dat ut: Deelen vun jemehr Blööd seht optisch ’n beten so ut as en Sandimm, man togliek ströömt se ok grote Mengden vun de dree Stoffen ut, de in dat Pheromon binnen sünd, un d dat jüst in de richtige Proportschoon, as de Seken dat hebbt. Dordör warrt vele Heken to de Blöden lockt un maakt dor en sonöömte Pseudokopulatschoon, dat heet se versökt sik mit de vörtüüschte Partnersche op de Blööt to poren. För de Imm blifft de Spood natürlich ut, man de Pollen warrt dorbi op dat Insekt överdragen un so na annere Blöden bröcht, wat wichtig is för’t Foortplanten vun de Orchidee.
Kiek ok
[ännern | Bornkood ännern]Literatur
[ännern | Bornkood ännern]- Peter W. Atkins: Kurzlehrbuch Physikalische Chemie. Wiley-VCH, Weinheim 2001, ISBN 3-527-30433-9.
- Peter Pfeifer/Roland Reichelt (Hrsg.): H2O & Co Organische Chemie. Oldenbourg, München 2003, ISBN 3-486-16032-X.
- K. P. C. Vollhardt, Neil E. Schore: Organische Chemie. Wiley-VCH, Weinheim 2000, ISBN 3-527-29819-3.
- Eberhard Breitmaier, Günther Jung: Organische Chemie. Thieme, Stuttgart 2001, ISBN 3-13-541504-X.
- Clayden, Greeves, Warren & Wothers: Organic Chemistry. Oxford University Press, Oxford 2004, ISBN 0-19-850346-6.
- M. Ayasse, W. Francke, B. S. Hansson, F. Ibarra, C. Löfstedt, H. F. Paulus, F. P. Schiestl: Orchid pollination by sexual swindle. In: Nature. Macmillan Jounals, London 399.1999, 421, ISSN 0028-0836.
- F. Rommerskirchen, A. Plader, G. Eglinton, Y. Chikaraishi, J. Rullkötter: Chemotaxonomic significance of distribution and stable carbon isotopic composition of long-chain alkanes and alkan-1-ols in C4 grass waxes. In: Organic Geochemistry Elsevier, Amsterdam 37, 2006, Siet 1303-1332, ISSN 0146-6380.
Weblenken
[ännern | Bornkood ännern]- Enzyklopädie: Struktur, Binntostännen, Vörkamen, Bruuk, Egenschoppen un Opbo
- Vörkamen, Bruuk, Egenschoppen un Opbo
- Egenschoppen, Vörkamen, Nomenklatur un Isomeren
Borns
[ännern | Bornkood ännern]- ↑ IUPAC, Gold Book: alkanes
- ↑ Der Brockhaus, Naturwissenschaft und Technik, Mannheim; Spektrum Akademischer Verlag, Heidelbarg, 2003
- ↑ Uwe Meierhenrich: Amino Acids and the Asymmetry of Life, Springer-Verlag, Heidelbarg, Berlin 2008. ISBN 978-3-540-76885-2.
- ↑ Arnold Arni: Grundkurs Chemie I und II, Wiley-VCH, 2011, S. 18−19, ISBN 978-3-527-33068-3.
- ↑ Carlson, D.A., Langley, P.A., and Huyton, P. 1978. Sex pheromone of the tsetse fly: isolation, identification, and synthesis of contact aphrodisiacs. In: Science. 201:750-753.