Oxidatschoonstall
De Oxidatschoonstall Nox (ok as Oxidatschoonsstoop betekent) is en Begreep ut de Chemie un gifft an, woveel Elementarladungen en Atom in en Verbinnen formal opnahmen oder afgeven hett.
Dat gifft noch en annere Definitschoon: De Oxidatschoonstall vun en Atom in en cheemsch Verbinnen is formal en Maat för de Angaav vun de Proportschonen vun de Elektronendicht üm dat Atom. En positive Oxidatschoonstall wiest an, dat de Elektronendicht in’n Vergliek to’n Normaltostand lütter worrn is, en negative Tall wiest an, dat de Elektronendicht tonahmen hett.
De Oxidatschoonstall is en för cheemsch Överleggen sinnvull Formalismus, de faken blots wenig mit de wirkliche Laden vun en Atom to doon hett. So kann dat woll vörkommen, dat Atomen in en Verbinnen en formal negative Oxidatschoonsstoop toordent warrt, ofschonst se togliek en formal positiv Formalladungen dregen künnt. In Kovalent Binnen ünenrscheedt sik de Oxidatschoonstall vun den Begreep vun de Weertigkeit.
Sinn un Angaav vun de Oxidatschoonsstoop
[ännern | Bornkood ännern]De Oxidatschoonstallen maakt bi Redoxreakschonen düüdlich, woneem de Vörgäng afloopt. Dat Överdregen vun Elektronen vun dat een Atom op en anner’t wiest sik doran, dat de Oxidatschoonstall vun dat een stiggt (dat Atom, wat en Elektron afgifft), wiel dat vun dat annere lütter warrt. Faken warrt eerst dör dat Bestimmen vun de Oxidatschoonstallen kloor, woneem en cheemsch reakschoon aflöpt.
De Oxidatschoonstallen warrt in Verbinnen in röömsch Tallen över de Atomteken schreven (Bsp. ). Wenn dat Atomteken alleen steiht, warrt se ok faken in araabsch Tallen as bi de Ionen schreven. Na de Konventschonen vun de IUPAC warrt blots bi negative Oxidatschoonstallen ein Vörteken sett.
Bestimmen vun de Oxidatschoonstall
[ännern | Bornkood ännern]För’t Herleiden vun de Oxidatschoonstall gifft dat de nafolgend Regeln:
- Atomen in’n elementaren Tostand hebbt jümmer de Oxidatschoonstall 0 (0 is aver ok in Verbinnen mööglich).
- Bi eenatomig Ionen is de Oxidatschoonstall liek de Ionenladungen.
- De Summ vun all Oxidatschoonstallen in en neutral mehratomig Verbinnen is 0.
- De Summ vun all Oxidatschoonstallen in en mehratomig Ion is liek de Gesamtladung vun dat Ion.
- Bi kovalent formuleerte Verbinnen (so nöömte Valenzstreekformeln, Lewis-Formeln) warrt de Verbinnen formal in Ionen opdeelt. Dorbi warrt annahmen, dat de an en Binnen bedeeligten Elektronen vun dat elektronegativere Atom vullstännig övernahmen warrt.
- De mehrsten Elementen künnt in mehrere Oxidatschoonsstopen vörkamen.
Helpsregeln
[ännern | Bornkood ännern]In de Praxis hett sik wiest, dat dat helpriek is, för de Bestimmen en poor Regeln optostellen:
- Metallatomen hebbt in Verbinnen un as Ionen jümmer en positive Oxidatschoonstall.
- Alkalimetallen hebbt jümmer de Oxidatschoonsstoop +I, un Eerdalkalimetallen jümmer +II
- Dat Fluoratom hett in Verbinnen – afsehn vun Vebrinnen mit sik sülvst – jümmer de Oxidatschoonstall -I
- En Waterstoffatom hett in Allgemenen de Oxidatschoonstall +I – mit Utnahm vun Vebrinnen mit sik sülvst oder mit weniger elektronegativen Metallen (Hydriden)
- En Suerstoffatom hett in’n Allgemenen de Oxidatschoonstall -II, in Peroxiden -I un mit Fluor +II (kiek aver ok de Regeln 7 un 9).
- Halogenatomen (Fluor, Chlor, Brom, Jod) hebbt in’n Allgemenen de Oxidatschoonstall -I, mit Utnahm vun Verbinnen mit Suerstoff oder Halogenen, de in’t Periodensystem höger staht.
- In’n elementaren Tostand: Oxidatschoonstall is 0 (to’n Bispeel I2, C, O2, P4, S8)
- In Ionenverbinnen is de Summ vun de Oxidatschoonsstopen liek de Ionenladen.
- In kovalente Binnen warrt de Binnelektronen den elektronegativeren Atom toordent. Lieke Binnpartner warrt jümmer de Hälfte vun de elektronen toordent. De Oxiatschoonstall is denn liek de Tall vun de toordent Binnelektronen in’n Vergliek to de Butenelektronen, de normalerwies dor sünd.
Graphisch Bestimmen vun de Oxidatschoonstall
[ännern | Bornkood ännern]As Bispeel bekiekt wi de Phosphorsüür (H3PO4):
- Toeerst warrt de Lewis-Formel optekend.
- Dorna warrt de Elektronen na de Eltronegativität to de Atomen toordent.
- Utgahnend vun de Valenzelektronen kann denn de Oxidatschoonsstoop utrekend warrn.
- Bispeel: Suerstoff hett normalerwies söss Valenzelektronen (6. Hööftgrupp). Vunwegen de högeren Elektronegativität vun’n Suerstoff warrt de Binnenelektronen twüschen Suer- un Waterstoff (oder Phosphor) den Suerstoff toslahn. In de Bilanz hett de Suerstoff dorüm twee tosätzliche Elektronen to de söss Elektronen. De Oxidatschoonstall vun’n Suerstoff is dorüm -II. De Waterstoff gifft dat Elektron af un hett dorüm +I. De Phosphor steiht in de 5. Hööftgrupp, hett also normalerwies fief Valenzelektronen. De warrt aver all den Suerstoff toordent. Dormit fehlt em fief Elektronen un kriggt dorüm de Oxidatschoonstall +V.
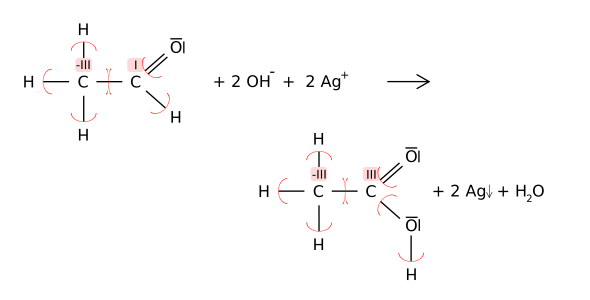
Dat nafolgend Bispeel (de Tollensproov/Sülverspegelproov) wiest todem, dat en Atom (as hier dat Kohlenstoff-Atom) ünnerscheedlich Oxidatschoonstallen hebben kann, un woneem sik de Oxidatschoonsstopen wiel en Reakschoon ännern doot: