Ether
Ether (vun’t greeksche aither, ᾿αιθήρ = „bövere Luft“, „Füürluft“; oolt ok: Äther) is be Beteken för en cheemsche Stoffgrupp vun orgaansche Verbinnen, de en Ethergrupp as funkschonelle Grupp bargt. Disse Grupp besteiht ut en Suerstoffatom, dat mit twee Organylresten substitueert is. In de Ümgangsspraak is mit Ether tomeist de Diethylether (H5C2–O–C2H5) meent, een vun de wichtigsten un eenfachsten Ethers. Wenn beide Resten an de Suerstoffbrüch aliphaatsch sünd, warrt disse Ethers na de Regeln vun de IUPAC ok as Alkoxyalkanen betekent[1].
Natürlich Vörkamen
[ännern | Bornkood ännern]Ethers gifft dat veel in de Natur. So leegt to’n Bispeel de meisten Monosacchariden in en zyklische Halfaceta-Form vör, de faktisch intramolekulare, geminal anordente Di-Ether sünd. De glycosidische Binnen vun de Polysacchariden is en Suerstoffbrüch twüschen twee Kohlenstoffatomen. Man ok vele annere Naturstoffen sünd Ethers, as to’n Bispeel de Aromastoffen Anethol, 1,8-Cineol, Eugenol oder Vanillin.
Struktur
[ännern | Bornkood ännern]
Allgemeen kann en Ether as
dorstellt warrn. R1 un R2 sünd dorbi Alkyl- oder Aryl-Resten, de in’n Fall vun zyklische Ethers mitenanner verbunnen sünd. De Binnenproportschonen in Ethers sünd vergliekbor mit de bi Alkoholen un bi’t Water, dat as Grundbosteen för disse beiden Klassen vun Verbinnen opfaat warrn kann. Kohlenstoff- un Suerstoffatomen sünd all sp3 hybridiseert. Dorüm sünd de Atomorbitalen üm all bedeeligte Atomen tetraedrisch anordent. De Binnenwinkel vun’n Suerstoff is wegen de in’n Vergliek to’n Waterstoff (104,5° in Water) voluminöseren Alkylsubstituenten mit 112° opwiet. De C–O-Binnen sünd mit ruchweg 143 pm so lang as in Alkoholen.
Nomenklatur
[ännern | Bornkood ännern]Na de Nomenklatur vun de IUPAC warrt aliphaatsche Ethers as Alkoxy-Alkanen betekent: R1–O–R2, wobi de Grupp O–R2 as Alkoxy-Substituent vun en Alkan-Keed R1 behannelt warrt. De nedderrangiste SUbstituent is hier de Alkoxy-Rest (–O–R2), wiel de högerrangige den Stamm vun’n Stoffnaam billt. De IUPAC lett ok to, dat beide Alkylresten tosamen mit de Ennen -ether nöömt warrt. Dat is sünners för lütte aliphaatsche Ethers begäng. Bi symmetrische Ethers is in den Fall de Beteken dör dat Vörstellen vun Di- eenfack to maken, as to’n Bispeel Diethylether ansteed vun Ethoxyethan. Zyklische un aromaatsche Ethers sünd meist all blots ünner jemehrn Trivialnaam bekannt.
Graadkeedige un vertwiegte Ethers
[ännern | Bornkood ännern]De richtige Naam folgt disse Regeln. Bispelen:
- De Verbinnen H3C–O–CH3 sett sik tosamen ut en H3C–O-Substituent un den Methylrest (CH3) as Stamm. In dissen Fall sünd aver beide Resten gliekweertig. De Verbinnen heet also Methoxymethan oder Dimethylether:

- H3C–O–CH–(CH3)2 heet 2-Methoxypropan oder Isopropylmethylether. De högerrangige Propan-Keed billt den Stammnaam, an de en Methoxy-Substituent an 2- (oder iso-) Positschoon vun’n Propylrest bunnen is:

- FH2C–CH2–O–CH2-CH3 warrt as 1-Ethoxy-2-fluorethan betekent. Prinzipiell sünd beide Keden gliekrangig, man de fluoreerte (un domit höger substitueerte) Rest billt den Naamsstamm:

Zyklische Ethers
[ännern | Bornkood ännern]Zyklische Ethers warrt as Zykloalkanen ansehn, bi de een (oder mehrere) C-Atom(en) dör een (oder mehrere) O-Atom(en) uttuuscht worrn sünd. Üm dat düütlich to maken, warrt na dat Hantzsch-Widman-System de Sülv Oxa an de richtige Steed inföögt. Bispeel:

De IUPAC-Naam is Oxacyclohexan. De Verbinnen warrt aver meist blots ünner den Naam Tetrahydropyran opföhrt. De Verbinnen is zyklisch (cyclo), hett en Ringgrött vun söss Atomen (hexan) un an een Steed is en C-Atom dör en Suerstoff-Atom uttuuscht (oxa). Dormit gellt för de Verbinnen ünnen de Naam 4-Fluoroxacyclohexan oder – mehr begäng – 4-Fluortetrahydropyran. Dorbi warrt dat Heteroatom (Suerstoff, O) in’n Ring de Positschoon 1 toordent.

Egenschoppen
[ännern | Bornkood ännern]De meisten Ethers sünd reakschoonstraag un warrt faken as Löösmiddels in de präparativen orgaanschen Chemie bruukt. Högere Erthers künnt wegen de anwassen sterische Hinnern nich so goot Waterstoffbrüchenbinnen utbilln, so dat de Lööslichkeit in Water mit stiegen Grött vun’n Alkylrest gau afnimmt.
| Utwählte Daten vun eenige apenkedige Ethers | |||||
|---|---|---|---|---|---|
| Ether | Struktur | Smp. °C | Kp. °C | Lööslichkeit (in een Liter H2O) | Dipoolmoment |
| Dimethylether[2] | H3C–O–CH3 | −138,5 | −23,0 | 70 g | 1,30 D |
| Diethylether[3] | H5C2–O–C2H5 | −116,3 | 34,4 | 69 g | 1,14 D |
| Di-n-propylether[4] | H7C3–O–C3H7 | −123,2 | 90,1 | 4,9 g | 1,32 D |
In starke Süren sünd Ether wegen de Protoneeren, de dorin stattfinnt, dorgegen ünner Billn vun Oxonium-Ionen goot to lösen.
De physikaalschen Egenschoppen vun de Ethers ünnerscheedt sik düütlich vun de Alkoholen mit glieke molare Masse. De Smölt- un Kaakpunkten vun de Ethers sünd veel sieter as de vergliekboren Alkoholen. To’n Bispeel liggt de Smöltpunkt vun den Alkohol Morphin bi 253 °C, de vun sien Methoxyether Codein dorgegen bi 157 °C. De hoge Elektronegativität vun’n Suerstoff is aver jüst as bi de Alkoholen verantwoortlich för de wesentlichen Egenschoppen vun de Ethers. Sünners bi zyklische Ethers föhrt dat to’n Utbilln vun en utprägt Dipoolmoment. Butendem liggt dat polare Suerstoffatom in en zyklischen Struktur an rutragender Steed vör. Dat warrt vun de Waterlööslichkeit vun eenige zyklische Ethers bewiest.
| Utwählte Daten vun eenige zyklische Ethers | |||||
|---|---|---|---|---|---|
| Ether | Struktur | Smp. °C | Kp. °C | Lööslichkeit (in en Liter H2O) | Dipoolmoment |
| Tetrahydrofuran | 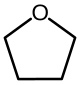 |
−108,4 | 66,0 | ahn Inschränken | 1,74 D |
| 1,4-Dioxan |  |
11,8 | 101,3 | ahn Inschränken | 0,45 D |
Dat siete Dipoolmoment vun’t 1,4-Dioxan warrt dör sien symmetrische Struktur veroorsaakt: de beiden Suerstoffatomen, de sik in’n Ring gegenöver staht, minnert de Samtpolarität in’t Molekül.
Ethersynthees
[ännern | Bornkood ännern]Williamson-Ethersynthees
[ännern | Bornkood ännern]För Ethers gifft dat verschedene Weeg för de Synthees. De wohrschienlich bekanntste Mechanismus is de Williamson-Ethersynthees. Dorbi warrt en Alkali-Alkoholat mit en Halogenalkan ümsett, wobi blangen dat Alkali-Halogen-Solt (nich wiest) de Ether entsteiht.
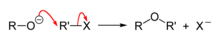
De Reakschoon verlöpt na en SN2-Mechanismus un warrt to’n Dorstellen vun eenfache un mischte Ethers bruukt. As Navenreakschoon kann en Elimineeren vörkamen, so dat de Anwennen vun de Williamson-Ethersynthees mit tertiäre Halogenalkanen keen Sinn maakt.
De Williamson-Ethersynthees föhrt bi intramolekuläre Reakschonen to zyklische Ethers. De eenfachsten Vertreder vun disse Klass is dat Oxacyclopropan (Ethylenoxid, Oxiran); de bekanntste Vertreder is dat Tetrahydrofuran (THF), wat in de orgaansche Chemie geern as Löösmiddel bruukt warrt.
Süürkatalyseerte Kondensatschoon vun Alkoholen
[ännern | Bornkood ännern]Ünner Süürkatalyys (in dissen Fall Swevelsüür) künnt twee Molekülen Alkohol (hier an’t Bispeel Ethanol wiest) to een Ether kondenseert warrn (hier Diethylether).
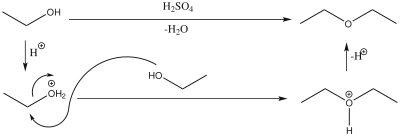
De bövere Piel wiest de Samtreakschoon, ünnen is de Reakschoonsvörgang dorstellt. Na’t Protoneeren vun’n Alkohol to en Oxonium-Ion warrt de vun en tweet Alkohol-Molekül nukleophil angrepen. Dorbi geiht Water ut dat Molekül rut. Dat Dialkyloxonium-Ion, wat dorbi tostannen kummt, warrt deprotoneert, wobi Ether entsteiht. Warrt dorbi en reine Alkoholoort bruukt, künnt op dissen Weg symmetrische Ethers dorstellt warrn.
Additschoon vun Alkoholen an Dubbelbinnen
[ännern | Bornkood ännern]Alkoholen künnt an Dubbelbinnen adderen, wobi toeerst dat Proton vun en togeven Süür elektrophil an de Dubbelbinnen addeert warrt. Dorna lagert sik de Alkohol nukleophil an. De Ether etnsteiht denn dör Deprotoneeren:

Sünnere Ethers
[ännern | Bornkood ännern]
Heteroether
[ännern | Bornkood ännern]Blangen de „normalen“ Ethers, de ut Alkylresten mit Suerstoffbrüch bestaht, gifft dat ok Analoga mit Verwandte vun’n Suerstoff. In de 6. Hööftgrupp folgt op den Suerstoff de Swevel. De billt na de baven nöömten Regeln so nöömte Thioethers. Bi de Stoffen gifft dat Steed vun en Suerstoffbrüch en Swevelbrüch. To de bekanntsen Thioethers tellt dat „Sempgas“ (oder S-Lost]] un de Aminosüür Methionin.
Kronenether
[ännern | Bornkood ännern]
Kronenethers sünd en sünnere Grupp vun zyklische Ethers, de in de Chemie vun Leevwesens aver ok in de technischen Chemie en Rull speelt. Allgemeen sünd dat zyklische Ethers, de ut anenanner bunnen 1,2-Diethers bestaht. De Nomenklatur vun Kronenethers is ungewöhnlich. Een vun de eenfachsten Kronenethers is [12]Kroon-4. Dorbi gifft [12] de Samttall vun de Atomen in’t de Molekül-Kroon an (ahn Waterstoffatomen) un -4 de Tall vun de Suerstoffatomen in de Kroon. Kronenethers hebbt de sünnere Egenoort, dat se Metallatomen oder -ionen in jemehr Struktur binnen künnt un dormit as Bostenen för Transportsystemen vun disse Metallen deent[5].
Polyether
[ännern | Bornkood ännern]
Langkedige Verbinnen vun de Oort
warrt Polyethers (ok Polyalkylenglycole, Polyetherpolyole, Polyalkylenoxide) nöömt. Bispelen för disse Grupp vun poylmere Ethers sünd Polyethylenglycol un Polypropylenglycol, de beid dör katalytische Polymerisatschoon vun de tohören Epoxiden (Oxiranen) Ethylenoxid oder Propylenoxid herstellt warrt. In’n Fall vun Polyethylenglycol un Polypropylenglycol sünd all Resten (R1, R2, R3…) mit Utnahm vun de Endlidden vun de Keed gliek.
Bi’t Ümsetten vun Epoxiden mit Diolen künnt verschedenste Polymeren entstahn. De Togaav vun en eenfach Alkanol ünnerbrickt de Polymeriseeren. Ok Epoxidhorzen sünd Polyether mit endstännige Epoxidgruppen. Polyetherdiolen, as to’n Bispeel Polyethylenglycol, sünd wichtige Vörprodukten bi de cheemschen Reakschoon mit Isocyanaten to Polyurethanen.
Gefahrenhenwies un Lagern
[ännern | Bornkood ännern]Autoxidatschoon
[ännern | Bornkood ännern]Bi’t Opbewahren vun Ethers an Licht billt de mit den Luftsuerstoff Peroxiden. De künnt sik bi de (Vakuum)-Destillatschoon vun en Ether in’n Rüchstand ansammeln un to Explosionen föhren.

Dorbi warrt in α-Positschoon to dat Suerstoffatom en Waterstoffatom ünner Billn vun en Radikal abstraheert, wobi sik mit SUerstoff en Peroxid billt[6]. En Utnahm stellt Methyl-tert-butylether (MTBE) dor, vunwegen dat disse Stoff op de tert-Butyl-Siet keen α-stännigen Waterstoff bargt un op de Methylsiet dat Entstahn vun en Radikal to ungünstig is.
De Peroxiden künnt tomeist dör Bruunfarven vun etigsuur Iodid-Lösen nawiest warrn. Dorbi warrt Iodid to Jod oxideert, dat mit Iodid to I3− reageert un för de brune Farv veratnwoortlich is. In’n Hannel gifft dat bito sünnere Proov-Stääv. Dat Peroxid kann to’n Bispeel mit Iesen(II)-Solten wegmaakt warrn. Dat Lagern vun Ethers för den Bruuk in’t Labor schüll dorüm blots in lütte Mengden bit to 1 Liter över Kaliumhydroxid-Plätzchen in Bruunglasbuddels passeeren.
Annere
[ännern | Bornkood ännern]Bi’t Hanteeren mit siete Ethers schüll jemehr siete Kaakpunkt un de lichte Brennborkeit acht warrn. (Diethyl)Ether-Luft-Mischen sünd twüschen 2 un 36 Vol% explosiv. Wichtig is dorbi, dat Ether-Dämp keen Klöör hebbt un butendem ok sworer sünd as Luft. Se sammelt sik also an deepere Steden an. Ut den Grund un ok wegen jemehr Narkoos-Wirken schülln Ethers blots in Aftöög bruukt warrn, de goot arbeiten doot.
Bruuk
[ännern | Bornkood ännern]Wegen jemehr Egenschoppen sünd de meisten Ethers sünners go’e Löösmiddels, in de vele Verbinnen to lösen sünd, de sik in Water nich lööst. De gröttste Deel vun’t produzeerte Diethylether warrt dorüm as Löösmiddel in’t Ümfeld vun de cheemschen un medizinschen Industrie un in Labors verbruukt.
Borns
[ännern | Bornkood ännern]- ↑ Axel Zeeck: Chemie für Mediziner, 6. Oplaag, Elsevier, Urban & Fischer Verlag, 2006, ISBN 978-3-43744435-7, S. 215.
- ↑ Indrag in de GESTIS-Stoffdatenbank vun’t Institut för Arbeitsschuul vun de Düütschen Gesettlichen Unfallversekern, afropen an’n 14. April 2012
- ↑ Indrag in de GESTIS-Stoffdatenbank vun’t Institut för Arbeitsschuul vun de Düütschen Gesettlichen Unfallversekern, afropen an’n 14. April 2012
- ↑ Indrag in de GESTIS-Stoffdatenbank vun’t Institut för Arbeitsschuul vun de Düütschen Gesettlichen Unfallversekern, afropen an’n 14. April 2012
- ↑ Axel Zeeck: Chemie für Mediziner, 6. Oplaag, Elsevier, Urban & Fischer Verlag, 2006, ISBN 978-3-43744435-7, S. 219.
- ↑ R. Brückner: Reaktionsmechanismen, 3. Opl., Spektrum, Heidelberg/Berlin 2004, ISBN 3-8274-1579-9, S. 41–43.
Literatur
[ännern | Bornkood ännern]- H. Beyer, W. Walter: Lehrbuch der Organischen Chemie, 21. Oplaag, S. Hirzel-Verlag, Stuttgart 1988, S. 144–147.
- A. Streitwieser, C. H. Heathcock, E. M. Kosower: Organische Chemie, VCH, Weinheim 1994, S. 232–243.


