Kohlenstoffdioxid
| Strukturformel | ||
|---|---|---|
| Allgemeen | ||
| Naam | Kohlenstoffdioxid | |
| Annere Naams | Kohlendioxid, Kohlenstoff(IV)-oxid, Dioxidokohlenstoff, CO2 | |
| Summenformel | CO2 | |
| CAS-Tall | 124-38-9 | |
| Kortbeschrieven | Gas ahn Klöör oder Röök | |
| Egenschoppen | ||
| Molar Masse | 44,0099 g·mol–1 | |
| Phaas | gasförmig | |
| Dicht | 1,9767 kg·m–3 (0°C, 1013 mbar)[1] | |
| Smöltpunkt | –56,6 °C (5,3 bar)[1] | |
| Kaakpunkt | –78,5 °C (Sublimatschoon)[1] | |
| Dampdruck | 57,258 bar[1] (20 °C) | |
| Löslichkeit |
3,3 g/l bi 0 °C, 1,7 g/l bi 20 °C, elk bi 1013 hPa[2] | |
| Sekerheitshenwiesen | ||
| Gefahrstoffkennteken | ||
| ||
| R- un S-Sätz | R: - | |
| S: 9-23 | ||
| Wietere Sekerheitshenwiesen | ||
| MAK | 9100 mg·m–3[1] | |
| Sowiet mööglich un tyypsch, warrt dat SI-Eenheitensystem bruukt. Wenn nich anners anmarkt, gellt de angeven Daten bi Standardbedingen. | ||
Kohlenstoffdioxid (in’n Alldag ok eenfach Kohlendioxid, mitünner ok verkehrterwies Kohlensüür nöömt) is en cheemsch Verbinnen, de ut Kohlenstoff un Suerstoff besteiht un blangen Kohlenstoffmonoxid, Kohlenstoffsuboxid un dat unbestännige Kohlenstofftrioxid to de Koppel vun de Kohlenstoffoxiden tellt.
Kohlenstoffdioxid is en Gas ahn Klöör un ahn Röök. Mit en Konzentratschoon vun ruchweg 0,04 % (in’t Johr 2006 üm un bi 381 ppm bi en Towass vun ungefähr 2 ppm elk Johr)[3] is dat en natürlichen Bestanddeel vun de Luft. Kohlenstoffdioxid entsteiht bi’t vullstännige Verbrennen vun kohlenstoffhollig Stoffen, wenn noog Suerstoff dor is, as ok in’n Organismus vun Leevwesen as’n Kuppelprodukt vun de Zellaten. Dat CO2 warrt dorbi bi’t Aten ut’n Lief afgeven. Annersrüm sünd Planten, enige Bakterien un Archeen in de Laag, CO2 dör’t Kohlenstoffdioxid-Fixeeren in Biomasse ümtowanneln. Op disse Wies produzeert Planten to’n Bispeel bi de Photosynthees ut anorgaansch CO2 Glukoos.
Herstellen
[ännern | Bornkood ännern]Affallprodukt vun de Energieweertschap
[ännern | Bornkood ännern]Kohlenstoffdioxid ensteiht bi’t Opböten vun kohlenstoffholige Brennstoffen, wat ok all fossilen Energiedrägers ümfaten deit. Bi en geven Energiedräger is de Mengde vun’t afgeven CO2 vun de Mengde vun den Brennstoff, also direkt vun de ümsetten Energie, afhangig. Moderne Anlagen un Bedrievstechniken sünd woll in de Laag, de Energie beter to nütten as in verleden Tieten, man dat Entstahn vun’t CO2-Gas künnt se nich hinnern.
Op disse Oord un Wies warrt weltwiet in’t Johr üm un bi 36 Mrd. Tünnen produzeert. Opstunns gifft dat noch keen wirksom un weertschopplich Verfohren, wat dat CO2 afscheden kann, so dat de hele Mengde in de Atmosphäär afgeven warrt un to’t global Ophitten bidrägen deit.
Technisch
[ännern | Bornkood ännern]Technisch warrt Kohlenstoffdioxid dör Verbrennen vun Koks mit överscherig Luft wunnen oder as Biprodukt bi’t Kalbrennen (~530 Mio t in’t Johr) un dat ansluten Reinmaken, as to’n Bispeel Binnen vun Kaliumcarbonat to Hydrogencarbonat un anslutend Freesetten dör Hittmaken.
Man, to’n Winnen warrt ok natürlich Gasborns (Mineralwater) bruukt.
In’t Labor
[ännern | Bornkood ännern]In lütte Mengden warrt Kohlenstoffdioxid dör reesetten ut Carbonaten dör Süren herstellt.
Nawies
[ännern | Bornkood ännern]En lichten Nawies vun Kohlenstoffdioxid geiht mit en waterige Calciumhydroxidlösen (Kalkwater). Dorto warrt dat Gas, dat ünnersocht warrn schall, in de Lösen inleidt. Wenn dat Gas CO2 bargt, denn warrt Calciumcarbonat (Kalk) as witten Faststoff utfällt un de Lösen warrt drööv.
- Kohlenstoffdioxid reageert mit Calciumhydroxid to Water un Calciumcarbonat.
Egenschoppen
[ännern | Bornkood ännern]
physikaalsch
[ännern | Bornkood ännern]
Dat Molekül vun’n Kohlenstoffdioxid is linear opboot. Ofschoonst de Kohelstoff-Suerstoff-Binnen polar sünd, maakt sik jemehr elektrisch Dipoolmomenten dör de Symmetrie vun’t Molekül na buten hen gegensietig tonichten. Dordör hett dat Molekül sülvst keen elektrischen Dipool. Man, vun wegen de binneren Dipolmomenten is Kohlenstoffdioxid liekers goot in Water to lösen, un absorbeert ok enige smalle Delen vun’t elektromagneetsche Spektrum in’t Rebeet vun de Infrarootstrahlen.
Kohlenstoffdioxid löst sik ruchweg veertigmol beter as to’n Bispeel Suerstoff. Bi Ruumtemperatur ünner Normaldruck is en lösen bi ruchweg 1.700 mg/l sättigt, wiel de Lösen bi Suerstoff al bi 9 mg/l un bi Stickstoff bi 20 mg/l sättigt is. Baven en Druck vun 60 bar is fletig Kohlenstoffdioxid bit fast halve-halve mit Water mischbor.
In faste Phaas warrt Kohlenstoffdioxid ünner de Beteken Dröögies in de Technik bruukt. Dröögies smölt nich, man dat sublimeert bi −78 °C. Dat is aver möglich, CO2 ünner den kritischen Punkt vun 31 °C dör grötteren Druck to en Fletigkeit ahn Klöör to verdichten. Bi Ruumtemperatur warrt dorto en Druck vun 60 bar bruukt, man bi de kritischen Temperatur ist de kritische Druck üm un bi 73,7 bar[1]. In fletige Form warrt Kohlenstoffdioxid in Druckbuddels hannelt.
cheemsch
[ännern | Bornkood ännern]Wenn sik Kohlenstoffdioxid in Water löst, billt sik Kohlensüür (H2CO3), wobi aver mehr as 99 % vun’t CO2 blots physikaalsch löst sünd. De Kohlensüür sülvst liggt in en cheemsch Gliekgewicht mit ehr Dissoziatschoonsprodukten (Spezies vör, neemlich Hydrogencarbonat („Bicarbonat“, HCO3–) un Carbonat (CO32–). In wovun Mengdenproportschoon de Stoffen vörleegt is afhangig vun den pH-Weert. Wenn de Oxonium-Ionen (H+ oder an sik H3O+), de sik bi de Dissoziatschoon billt, dör Togaav vun en Base mit Hydroxid-Ionen (OH–) affungen warrt, schufft sik de Mengdenproprotschhon na’t Carbonat hen.
Bruuk
[ännern | Bornkood ännern]
Bi de Sublimatschoon vun Kohlendioxidies kummt en witten Nevel tostannen dör dat kole CO2-Luft-Gemisch un kondenseeern Luftfuchtigkeit, de in verleden Tieten veel in de Bühntechnik insett worrn is in’t Theater. Vundaag gifft dat to’n Bispeel Nevelköhl-Vörsätz för normal Verdamper-Nevelmaschienen, de mit fletig CO2 bedreven warrt.
Vele Drinken bargt Kohlenstoffdioxid, üm en frischer’t Geföhl to maken. Bi enige Drinken as Beer oder Sekt kummt dat dör Gären tostannen, bi annere (Sodawater, Limonaad) warrt dat künstlich togeven oder een bruukt natürlich kohlenstoffdioxidhollig Mineralwater. As Levensmiddeltosatzstoff hett Kohlenstoffdioxid de Beteken E 290. Bi’t Herstellen warrt Kohlenstoffdioxid bi hogen Druck in dat Drinken pumpt. Dorbi reageert dat to ruchweg 0,2 % mit Water to Kohlensüür. De gröttste Deel warrt as Gas in’t Water löst. Bi’t Apenmaken vun de Buddel gifft dat en Druckaffall, de to en Nukleatschoon föhrt. Dat överscherig Gas neiht dordör in Form vun lütte Blasen ut un stiggt op. Dat Tostannenkamen vun de lütten Blasen un de süerliche Smack vun de Kohlensüür op de Tung reegt bi’t Drinken de Zellen för den Smacksinn an, wodör dat frische Geföhl utlöst warrt.
An Anwennen vun Kohlenstoffdioxid is ok in Afföhrmiddels (Zäpfchen). Dör en cheemsch Reakschoon wiel dat Oplösen vun’t Zäpfchen warrt CO2-Gas freesett, wat den Darm utdehnen deit. Dordör warrt de Stohlreflex utlöst.
Insett warrt dat Gas ok in Füerlöschers, wiel dat den Suerstoff vun’n Brandheerd verdrängt, kiek dorto ok ünner Brandbekämpen un Löschmiddel.
Kohlenstoffdioxid warrt ok as Dünger (Kohlenstoffdioxid-Dünger) in Drievhüüs insett. Dat hett den Sinn, dat in dat afslaten Huus dör de Photosynthees CO2 ümwannelt un dorüm vun de Planten as Nehrstoff bruukt warrt. Bi slecht Dörlüften is jichtens nich mehr noog dorvun in de Luft – sünners in’n Winter, wenn de Lüften vun wegen de Küll reduzeert oder afschallt warrt. Kohlenstoffdioxid warrt to’n een as rein Gas in dat Drievhuus inleidt, wat aver teemlich düer is, oder as Reakschoonsprodukt vun en Verbrennen as to’n Bispeel Propan oder Eerdgas. Dat kann as Verbinnen vun Warmmaken un Düngen ansehn warrn. Woveel beter de Planten dordör wasst, hangt dorvun af, wo groot de Mangel an CO2 is un woveel Licht de Planten kriegen doot. As Dünger warrt Kohlenstoffdioxid ok in de Aquaristik för Waterplanten insett. Dorför gifft dat den so nöömten CO2-Diffuser. Man dat kann ok dör Tosetten vun orgaansch Stoffen maakt warrn, wat aver denn to Lasten vun den Suerstoff-Andeel geiht.

Överkritisch Kohlenstoffdioxid kann bannig goot unpolaar Stoffen lösen un kann dorüm an de Steed vun giftige orgaansche Löösmiddels bruukt warrn. As Middel to’n Extraheeren warrt dat to’n Bispeel insett bi’t Extraheeren vun Naturstoffen as Koffein (Herstellen vun koffeeinfree Kaffee), as Löösmiddel to’n Reinmaken un Fettwegmaken, to’n Bispeel in de Halfleiderindustrie bi de Produkschoon vun Wafers und in jüngerer Tiet ok för Textilien (Cheemsch Reinmaken). Opstunns warrt ok düchtig utforscht, wat överkritisch Kohlenstoffdioxid as Reakschoonsmedium bi de Herstellen vun fiencheemsch Stoffen (t. B. Herstellen vun Aromastoffen) bruukt warrn kann, wieldat isoleerte Enzymen dor binnen faken aktiv aver keen Löösmiddelrückstännen in de Produkten binnen blievt – anners as bi orgaansch Löösmiddels.
As Küllmiddel warrt Kohlenstoffdioxid ünner de Beteken R744 oder R-744 in Fohrtüüch- un faste Klimaanlagen, bi Külltechnik in de Industrie, in Verkoopsteden oder bi’n Transport as ok in Drinkautomaten insett. CO2 hett en hoge Wirksomkeit bi en geven Volumen, en hoge Ümweltverdrägborkeit in’n Vergliek to annere Küllmiddels de insett warrt (boot keen Ozon af, lütter’t Drievhuuspotential, Winnen ut industriell Affallgas) un kann togliek in Warmskreislööp as in Warmwaterpumpen oder Fohrtüüchheizungen bruukt warrn.[4]
In de Schweißtechnik warrt Kohlenstoffdioxid as Schuulgas bruukt, mol in Reinform, aver fakener as Tosatz to Argon oder Helium (oder beid). Dat Gas is aver bi hoge Temperaturen thermodynaamsch unbestännig. Dorüm warrt dat nich as Inertgas, man as Aktivgas betekent.
In tonehmen Maat warrt CO2 in Verbinnen mit en automatiseert Strahlverfohren anwennt, üm hoochreine Bavenflachen to tügen. Mit sien Kombinatschoon ut mechaansch, thermisch un Cheemsch Egenschoppen kann ünner annern CO2-Snee ünnerscheedlichste Oorden vun Dreck op Bavenflachen ahn rückstännen lösen un afdrägen.
In so nöömte CO2-Anlagen warrt in letzter Tiet Swien benüsselt, bevör se slacht warrt. Dorto warrt se in Koppels in en Oort Paternosterfohrstohl in en Gruuv daallaten, de tomindest 90% Kohlenstoffdioxid bargt.
CO2 in de Atmosphäär un Drievhuuseffekt
[ännern | Bornkood ännern]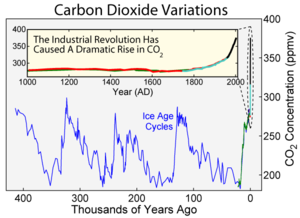
Hööftartikel: Drievhuuseffekt
Kohlenstoffdioxid absorbeert en Deel vun de Infrarootstrahlen, dat is de Deel ut dat elektromagneetsch Spektrum, dat wi as Warms op de Huut föhlen doot un ok Warmsstrahlen nöömt warrt, wiel Strahlen mit körtere Bülgenläng – also de gröttste Deel vun de Sünninstrahlen – eenfach dörneihn kann. Vun wegen disse Egenschap is Kohlenstoffdioxid en Drievhuusgas. Na Waterdamp is Kohlenstoffdioxid dör sien Mengenandeel in de Atmosphäär dat tweetwirksomste Drievhuusgas, ofschoonst annere Gasen as Methan oder Ozon en högere spezifische Wirksomkeit hebbt. All disse Gasen tohopen sett de dörsnittliche Temperatur op de Eerdbavenflach vun ruchweg -18 °C op +15 °C hooch, wat as natürlich Drievhuuseffekt betekent warrt. Kohlenstoffdioxid hett an den gesamten Effekt en Andeel vun ruchweg 9 bit 26 % un is dormit to’n groten Deel dorvör mitverantwoortlich, dat de Eer in’n Grundsatz so’n leeftallig un frünnlich Klima opwiest.
De CO2-Andeel in de Atmosphäär hett sik in’n Verloop vun de Eerdhistorie veelfach ännert, wat sien Oorsaak in verscheden bioloogsch, cheemsch un physikaalsch Saken hett. Man, siet tomindest 650.000 Johren leeg de Andeel jümmer ünner 280 ppm.[5] In de letzten 10.000 Johren bleev de Konzentratschoon teemlich gliek bi 280 ppm. Ünnern’n Streek weer de Kohlenstoffdioxidkreisloop also in disse Tiet teemlich utgleken. Man, as de Industrialiseeren losgüng in’t 19. Johrhunnert, is de CO2-Andeel in de Atmosphäär langsom jümmer wieter anstegen op vundaag 381 ppm (Stand: 2006) un stiggt to Tiet in’n Dörsnitt wieter üm 1,5 bit 2 ppm in’t Johr.[6]
De anthropogen – d. h. vun Minschen veroorsaakt – Kohlenstoffdioxid-Freesetten vun ruchweg 36,3 Gt oder 9,9 Gt Kohlenstoff in’t Johr (8,4 GtC dör’t Verbrennen vun fossile Rohstoffen un 1,5 ± 0,5 GtC dör’t Nütten vun’t Land)[6] sünd blots en lütten Deel vun dat vör allen ut natürlich Borns stammen Kohlenstoffdioxid, dat sik in’t Johr op ruchweg 550 GtCO2 oder 150 Gt Kohlenstoff belöpt.[7] Dör’t globale Afholten vun Wooldrebeden künnt de anthropogenen CO2-Emisschonen blots to ruchweg 45 % vun de natürlichen Kohlenstoffdioxidsenken opnahmen warrn, so dat sik dat överscherig Kohlenstoffdioxid in de Atmosphäär ansammelt. De Verbrennen vun Biomasse un de dorut wunnen Drievstoffen sett – ahn den Energiebruuk in de Landweertschap to achten – ünner’n Streek blots CO2-Mengden free, de vörher photosytheetsch bunnen worrn sünd.
In de Wetenschap warrt siet laatstens de 1990er Johren acht, dat dat en statistisch signifikante Ännern vun’t Klima gifft, de tomindst to’n Deel op dat Anstiegen vun de Kohlenstoffdioxidkonzentratschoon in de Atmosphäär is. Anfangs weer disse Verdacht noch teemlich unseker, man mit de Tiet un mit wietergahn Utforschen un düchtigen Striet üm dat global Ophitten is de Tosamenhang jümmer klorer worrn un warrt vundaag wietgahen acht.[8] Ahn Acht op de Drievhuusgasen sünd de beobachten Temperaturdaten na Ansicht vun de meisten Wetenschopplers nich to verkloren.[9] De Naklapp vun’t global Ophitten schüllt dör Klimaschuul minnert warrn.
Physioloogsch Wirken un Gefahren
[ännern | Bornkood ännern]Wenn de Suerstoff in de Luft dör CO2 uttuuscht warrt, as t. dör Verbruuk dör Aten in afslaten Rüüm, hett de ännerte Andeel Utwirken op den Minschen. De nafolgend Tabell wiest de Wirken bi geven CO2-Konzentratschonen (Vol-%):
- 0,038 %: opstunns normale Konzentratschoon in de Luft
- 0,15 %: Hygieensch Richtweert för Binnenrüüm för frische Luft
- 0,3 %: MIK-Weert, ünner den bi duersom Inwirken keen Bedenken för de Gesundheit besteiht
- 0,5 % (9 g/m³): MAK-Grenzweert för en regelmatig Utsetten vun acht Stünnen ann Dag
- 1,5 %: Anstiegen vun’t Atentietvolumen üm mehr as 40 %
- 4 %: Atenluft bi’t Utaten
- 5 %: Vörkamen vun Koppweh, Swinnel un Bewusstlosigkeit
- 8 %: Bewusstlosigkeit, Doodblieven na 30–60 Minuten
Jümmer wedder kamt Unfäll mit Kohlenstoffdioxid vör. Dat gifft Rüüm as Wienkellers, Fodersilos, Güllekuhlen un annere, woneem sik dör Gärvörgäng bannige Mengden vun Kohlenstoffdioxid billn künnt. Bi’t Gären vun een Liter Most kamt ruchweg 50 Liter Gärgas togang. Wenn dorbi nich noog lüft warrt, künnt sik gefährlich hoge Konzentratschonen billn, vun wegen dat Kohlenstoffdioxid en högere Dicht hett as de Luft un sik dorüm an’n Bodden ansammeln deit (Kohlenstoffdioxid-See). Ok in sünnere Höhlen un Bargwarksstollen bi’n Kahlafbo künnt mitünner bannig hoge CO2-Konzentratschonen vörliggen. Die so nöömte Hundshöhl in Italien hett en Konzentratschoon vun üm un bi 70 %!
De direkte Schadenswirken op Minsch un Beest kann in’n enkelten Fall op dat Verdrängen vun’n Suerstoff in de Luft torüch gahn, man, de wiet verbreedt Ansicht, dat Kohlenstoffdioxid an sik nich schädlich is un blots dör’t Suerstoffverdrängen wirkt, is verkehrt. De olle Kerzenproov to’n Faststellen vun’n gefährlich siete Suerstoffkonzentratschoon maakt dorüm wenig Sinn. Dör’t Verdrängen vun de Luft, also dat Rünnersetten vun’n Suerstoff-Deeldruck op weniger as 130 mbar, dör dat sworere Kohlenstoffdioxid kann dat aver tosätzlichen to den Schaden dör’t CO2 ok to’n Ersticken vun wegen Suerstoffmangel kamen. In Kahlbargwarken oder bi Gärvörgänbg künn dat ok to Exploschonen kamen, wenn blangen dat Kohlenstoffdioxid ok noch Methan in’t Gasmischen vörliggen de.
Kohlenstoffdioxid, dat in’t Blood löst is, sett in physioloogsch (natürlich) un licht högere Konzentratschoon dat Atenzentrum vun’n Bregen. Man, in düütlich högeren Konzentratschonen löst dat Gas en Minnern oder sogor en Utschalten vun’n Atenreflex ut un föhrt to Atendepresschoon oder Atenstillstand. Disse Utwirken paaseert veel gauer as dat Ersticken. Dat stimuleeren vun’t Atenzentrum dör Kohlenstoffdioxid warrt bi Notfallhelp na en Atenstillstand dör’n Dokter to’n Wedderbeleven utnütt. Dorbi warrt rein Suerstoff mit ruchweg 4-5 % Kohlenstoffdioxid mischt un den Patienten to’n Aten geven.
Mehr as ruchweg 5 % CO2 in de Atenluft löst Koppweh un Swinnengeföhl ut. Bi noch högere Konzentratschoon warrt de Hartslag gauer maakt (Tachykardie), de Blooddruck stiggt an un dat kummt to Atennoot un Bewusstlosigkeit. Dorto warrt ok Kohlenstoffdioxid-Narkoos seggt. Konzentratschonen vun mehr as 8 % föhrt binnen 30 bit 60 Minuten to’n Dood.
Butendem hett Kohlenstoffdioxid en indirekt Wirken op den Suerstoffandeel in’t Blood. Is mehr Kohlenstoffdioxid in de Luft oder in’t Frischwater, warrt in’t Blood över dat Dissoziatschoonsgliekgewicht vun de Kohlensüür de pH-Weert rünnersett un dat Blood warrt cheemsch surer. Dorvun warrt dat Hämoglobin bedrapen: Bi sieten pH-Weert minnert sik dat Vermögen, Suerstoff to binnen. Dat heet, bi de glieke Suerstoff-Konzentratschoon in de Luft kann dat Hämoglobin weniger Suerstoff an sik binnen un transporteeren. Disse Ümstand warrt dör den Bohr-Effekt un den Haldane-Effekt beschreven. In’t Geweev, woneem de Suerstoff hentransporteert warrn schall, is de Kohlenstoffdioxid-Konzentratschoon höger. Dat heet de pH-Weert is sieter un de Binnenkapazität för Suerstoff dordör lütter, wodör de Suerstoff dor lichter afgeven warrn kann. In de Lung is dat jüst anners rüm, wat för’t lichtere Opnehmen vun’n Suerstoff in’t Hämoglobin sorgt.
Disse indirekte Effekt över den pH-Weert vun’t Blood is aver wat anners as de wiet starkere Giftigkeit vun’t Kohlenstoffmonoxid. Dat Gas billt Komplexen un verdeckt den Iesenkarn vun’t Hämoglobin, wat de Opnahm vun Suerstoff ünnerbinnt. Dat is dormit en kumplett annern Vörgang as bi’t Kohlenstoffdioxid.
Jümmer wedder warrt hele Familien Oppers vun Gärgasvergiften, wieldat mehrere Personen jemehr Anhörigen retten wüllt un dorbi denn sülvst to veel Kohlenstoffdioxid inaten doot un bewusstlos warrt. Bi’n Versöök to helpen löpt man sülvst Gefahr, sik to vergiften, wieldat nümms in de Laag is, en Bewusstlosen ahn Intoaten ut’n Keller to drägen. Beter un sekerer is dat, toeerst för Belüften to sorgen un en Nootroop aftosetten.
Verunglückte Lüüd ut en CO2-verdächtig Situatschoon (Wienkellers, Silos usw.) to retten is blots dör professchonelle Insatzkräft (Füerwehr) mit akkeraten Atenschuul möglich.
In roor Fäll kann dat ok Naturkatastrophen mit Kohlenstoffdioxid geven. En bekannten Fall is 1986 an’n Nyos-See in Kamerun passeert, woneem dat CO2-Gas dör vulkanische Aktivität freesett worrn is.
De Richtweert för de Kohlenstoffdioxid-Konzentratschoon in Binnenrüüm vun 0,15 % kann överschreden warrn, wenn sik mehrere Lüüd över en längere Tiet in en lütten, slaten un goot isoleerten Ruum ophollen doot. Wenn sik in en Ruum mit en Grundflach vun 68 m² un en Ruumvolumen vun 203 m³ söven utwassen Lüüd ophollt, warrt in Afhangigkeit vun de Ruumisoleeren, de Konzentratschoon vun 0,15 % al na twee Stünnen överschreden. Gesundheitliche Bedenken gifft dat aver eerst, wenn de tolaten MAK-Weert för längere Tiet överschreden warrt.
Kiek ok
[ännern | Bornkood ännern]- Boudouard-Gliekgewicht
- CO2-Neutralität
- CO2-Sequestreeren
- Emisschoonsrechthannel
- Global Ophitten
- Kalkwaterproov
- Severinghaus-Elektrood
- Pasteur-Effekt
- Drievstoffverbruuk
- Versuern vun de See
Literatur
[ännern | Bornkood ännern]- Pörtner: Auswirkungen von CO2-Eintrag und Temperaturerhöhung auf die marine Biosphäre (pdf 1,3 MB, 85 S.)
- Bauer, Kurt: Zur Bedeutung der Kohlensäure in Karpfenteichen. Österreichs Fischerei 44/1991 S.49–64
Borns
[ännern | Bornkood ännern]- ↑ a b c d e f Indrag to Kohlenstoffdioxid in de GESTIS-Stoffdatenbank vun’t BGIA; Afropen an’n 31.8.2007
- ↑ Carbon Dioxide Solubility in Water
- ↑ Dr. Pieter Tans, NOAA/ESRL: Current Trends in CO2 (ESRL-Websiet)
- ↑ The natural refrigerant R744 (CO2)
- ↑ Siegenthaler, U., T. F. Stocker, E. Monnin, D. Lüthi, J. Schwander, B. Stauffer, D. Raynaud, J.-M. Barnola, H. Fischer, V. Masson-Delmotte un J. Jouzel (2005): Stable Carbon Cycle–Climate Relationship During the Late Pleistocene, in: Science, Vol. 310, No. 5752, S. 1313–1317, 25. November
- ↑ a b J. Canadella, C. Le Quéré, M. Raupacha, C. Fielde, E. Buitenhuisc, P. Ciaisf, T. Conwayg, N. Gillettc, R. Houghtonh und G. Marland (2007): Contributions to accelerating atmospheric CO2 growth from economic activity, carbon intensity, and efficiency of natural sinks, in: Proceedings of the National Academy of Sciences, online (PDF)
- ↑ Intergovernmental Panel on Climate Change (2001): Climate Change 2001 – IPCC Third Assessment ReportCO2-Kreislauf
- ↑ Oreskes, Naomi (2004): The Scientific Consensus on Climate Change, in: Science Vol. 306 vun’n 4. Dezember
- ↑ Meehl, Gerald A., Warren M. Washington, Caspar M Ammann, Julie M. Arblaster, T. M. L. Wigleiy un C. Tebaldi (2004): Combinations of Natural and Anthropogenic Forcings in Twentieth-Century Climate, in: Journal of Climate, Vol. 17, 1. Oktober, S. 3721–3727

