Chrom
| ||||||||||||||||||||||||||||||||||||||||
| Allgemeen | ||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Naam, Teken, Atomtall | Chrom, Cr, 24 | |||||||||||||||||||||||||||||||||||||||
| Cheemsch Serie | Övergangselement | |||||||||||||||||||||||||||||||||||||||
| Klöör | sülvern metallsch | |||||||||||||||||||||||||||||||||||||||
| Atommass | 51,9961 u | |||||||||||||||||||||||||||||||||||||||
| Elektronenkonfiguratschoon | [Ar]3d54s1 | |||||||||||||||||||||||||||||||||||||||
| Elektronen je Schaal | 2, 8, 13, 1 | |||||||||||||||||||||||||||||||||||||||
| Physikaalsche Egenschoppen | ||||||||||||||||||||||||||||||||||||||||
| Phaas | Faststoff | |||||||||||||||||||||||||||||||||||||||
| Dicht | 7,15 g·cm−3 (bi RT) | |||||||||||||||||||||||||||||||||||||||
| Smöltpunkt | 2180 K (1.907 °C) | |||||||||||||||||||||||||||||||||||||||
| Kaakpunkt | 2944 K (2.671°C) | |||||||||||||||||||||||||||||||||||||||
| Atomare Egenschoppen | ||||||||||||||||||||||||||||||||||||||||
| Kristallstruktur | kubisch ruumzentreert | |||||||||||||||||||||||||||||||||||||||
| Ionisatschoonsenergien | 1.: 652,9 kJ/mol | |||||||||||||||||||||||||||||||||||||||
| 2.: 1590,6 kJ/mol | ||||||||||||||||||||||||||||||||||||||||
| 3.: 2987 kJ/mol | ||||||||||||||||||||||||||||||||||||||||
| Atomradius | 140 pm | |||||||||||||||||||||||||||||||||||||||
| Annere Egenschoppen | ||||||||||||||||||||||||||||||||||||||||
| Isotopen (Utwahl) | ||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||
Chrom (vun’t gr.: chroma „Klöör“) is en cheemsch Element ut dat Periodensystem mit dat Atomteken Cr un de Atomtall 24. Chrom is en Metall, dat to de Övergangselementen tellt. Verbinnen vun Chrom hebbt veele verscheeden Klören un warrt dorüm faken as Pigmenten in Farven un Lacken bruukt.
Historie[ännern | Bornkood ännern]

Johann Gottlob Lehmann hett 1761 in’n Ural en orange-root Bliechromat-Mineral (PbCrO4) funnen, dat he Rootblieierz nöömt hett. Dat Chrom hett he dorbi aver toeerst nich opdeckt, wiel he dat Mineral vör en Blie-Iesen-Selen-Verbinnen hollen hett.
1770 hett Peter Simon Pallas an de lieken Steed en root Blie-Mineral funnen, dat he vun wegen sien Klöör Krokoit nöömt hett (vun’t gr.: krokos „safranklöört“). De Verwennen vun Rootblieierz as Pigment hett gau tonahmen. En ut Krokoit wunnen strahlendet Geel, dat Chromgeel, is dorna in Mood kamen, dat veele Lüüd as „Postgeel“ kennen doot.
Louis-Nicolas Vauquelin hett 1797 Chrom(III)oxid (Cr2O3) ut Krokoit un Soltsüür herstellt. Een Johr later hett he verunreinigt elementaret Chrom wunnen dör de Redukschoon vun Chrom(III)oxid mit Holtköhlen. Dit nee isoleerte Element hett denn vun wegen de velen Klören vun de Verbinnen den Naam Chrom kregen. Sporen vun dat Element kunn Vauquelin ok in Eddelstenen as Rubin un Smaragd nawiesen. In’t 19. Johrhunnert sünd Chromverbinenn to’n gröttsten Deel as Farvpigmenten insett worrn. An’n End vun’t 20. Johrhunnert weern Chrom un Chromverbinnen vör allen to’n Herstellen vun korrosions- un hittbestännige Legeeren verwendt.
Vörkamen[ännern | Bornkood ännern]
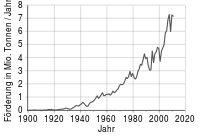
Chrom warrt meist blots as Chromit (Chromiesensteen, FeCr2O4) in’n Daagbo oder in bannig lütte Deep afboo. Metallsch Chrom warrt dör Redukschoon vun dat Ierz mit Aluminium oder Silizium wunnen.
2003 hett Süüdafrika ungefäähr 50 % vun de weltwiete Nafraag an Chromit föddert. Annere bedüdende Födderlänner sünd Kasachstan (15,2 %), Indien (12,1 %), Simbabwe (3,7 %) un Finnland (3 %)
In’t Johr 2000 weern ruch weg 15 Millionen Tünnen vermarktbor Chromitierz afboot. Dorut leet sik 4 Mio. Tünnen Ferrochrom mit en Weert vun 2,5 Mio. US-Dollar winnen. Metallsch Chrom kummt in de Lagersteden blots ganz wenig vör. In de Udatschnaja-Mien in Russland warrt en demanthollig Kimberlit-Rohr utbüüt. In de reduzeerten Matrix billt sik Demanten un metallsch Chrom.
Winnen un Dorstellen[ännern | Bornkood ännern]
Dat Chromitierz warrt toeerst vun den doven Steen freemaakt un denn bi ruch weg 1200 °C to Chromat oxideert:
- 4 FeCr2O4 + 8 Na2CO3 + 7 O2 → 8 Na2CrO4 + 2 Fe2O3 + 8 CO2
DatNatriumchromat warrt mit hitt Water rutlöst un mit Swevelsüür na Dichromat överföhrt:
- 2 Na2CrO4 + H2SO4 → Na2Cr2O7 + Na2SO4 + H2O
Natriumdichromat kristalliseert bi't Afköhlen as Dihydrat ut de Lösen. Dör en anslutend Redukschoon mit Köhlen kriggt man Chrom(III)-oxid:
- Na2Cr2O7 · 2 H2O + 2 C → Cr2O3 + Na2CO3 + 2 H2O + CO
Dorna kummt de aluminothermisch Redukschoon vun dat Chrom(III)-oxid to Chrom:
- Cr2O3 + 2 Al → Al2O3 + 2 Cr
Ut de oxidischen Ierzen kann Chrom nich dör Redukschoon wunnen warrn, wiel dorbi Chromkarbid entsteiht. Reineret Chrom warrt dör elektrolytisch Afscheeden vun dat Cr3+-Ion ut swevelsuur Lösen dorstellt. Solk Lösen warrt herstellt dör Oplösen vun Chrom(III)-oxid oder Ferroschrom in Swevelsüür. Ferrochrom as Utgangsmaterial föddert aver dat vörherig Afscheeden vun dat Iesen.
Düchtig rein Chrom warrt dör wietere Stopen Reinigen na dat van-Arkel-de-Boer-Verfohren maakt.
Ferrochrom warrt dör Redukschoon vun Chromit in’n Lichtbagenaven bi 2800 °C herstellt.
- FeCr2O4 + 4 C → Fe + 2 Cr + 4 CO
Egenschoppen[ännern | Bornkood ännern]

Chrom is en sülverwitt, korrosions- un anloopbestänniget hart Metall, dat in Oortostand taach, frombor un smeedtbor is. Faken Oxidatschoonstallen sünd +2, + 3 un +6, wobi aver +3 de bestännigste is.
Chrom is mit d4 unbestännig. Dat gifft kuum en Redukschoonsmiddel, dat so gau Suerstoff ut de Luft opnimmt as Cr(II). Aver ok ahn Lufttogang sünd Cr2+-Lösen blots denn för korte Tiet bestännig, wenn se ut reinsten Chrom (t. B. Elektrolytchrom) wunnen warrt.
Cr3+ is de bestännigste Form. Dat warrt mit de Kristallfeldtheorie verklort, wona de d3 Konfiguratschoon dör en halfopfüllte Ünnerschaal stabiliseert is.
Cr(VI) als Chromat (CrO42−) btw. Dichromat (Cr2O72−) warrt as stark Oxidatschoonsmiddel insett. Dat is giftig un kann Kreeft utlösen. In waterige Lösen liggt twüschen de beiden Ionen en cheemsch Gliekgewicht vör, dat unafhangig vun de pH-Weert is. Wenn man en verdünnte gele Chromat-Lösen ansüert, also H+-Ionen bigifft, denn verschufft sik dat Gliekgewicht na dat Prinzip vun Le Chatelier in Richt vun dat Dichromat. De Lösen farvt sik denn orange:
- 2CrO42− + 2H+ ↔ Cr2O72− + H2O
Bedüden för Liev un Leven[ännern | Bornkood ännern]
In elementare Form hett Chrom keen physioloogsch Bedüden för in’n minschlichen Lief.
De Rull vun Cr(III) (Cr3+-Ionen) in’n Lief warrt opstunns noch diskuteert. Dat gifft Henwiesen dorop, dat Cr(III) en Bedüden in’n Kohlenhydrat- un Fettstoffwessel vun Söögdeerten hebben künn. Dat warrt to Tiet noch napröövt. Henwiesen, de man fröher mol sehn hett, dat de Nehrmiddeltosatzstoff Cr(III)picolinat en goden Influss op den Liefbo hett, künnen dör Studien nich nawiest warrn. In en Ünnersöken mit Hamsterzellen künn aver wiest warrn, dat Cr(III)picolinat mutagen is un Kreeft utlösen kann.
De opstunns verföögboren Daten wiest dorop hen, dat dat bannig swor is, to wenig Chrom to sik to nehmen. Giftig wirkt Cr(III) ok bi gröttere Mengden blots swor, wiel dat Löslichkeitsprodukt vun Cr(III)hydroxid düchtig siet is (6,7 · 10-31). In’n Darm vun’n Minschen warrt dat dorüm blots bannig swor opnahmen. In de USA is de anraadt Opnahmmengde Cr(III) vun 50-200 µg/d op 35 µg/d för utwossen Mannslüüd un op 25 µg/d för utwossen Fronslüüd rünnersett worrn.
Cr(VI)-Verbinnen sünd düchtig giftig. Se sünd mutagen un veroorsaakt Schaden an de DNS.
Nawies[ännern | Bornkood ännern]
Chrom-III-Solten geevt in’n Kationenscheedgang bi de Nawiesreakschoon mit dat „Alkalisch Bad“ (Ätznatron in konzentreert Waterstoffperoxid-Lösen) gele Chromatlösen, de in Süür to orange Dichromat reageert:
- 3 H2O2 + 2 Cr3+ + 10 OH− → 2 CrO42− (geel) + 8 H2O
- De Chromaten un Dichromaten sünd kreeftutlösend un giftig! Dör Togaav vun Süür un Metall kann de Giftigkeit reduzeert warrn, wobi dör Inwirken vun dat Redukschoonsmiddel naszeerend Waterstoff wedder gröne Chrom-III-Ionen tostannen kamt.
En charakteritischen Nawies för Cr(VI) is dat Billn vun blau Chrom(VI)-Peroxid (CrO(O2)2, faken ok CrO5 schreven). Dorför warrt de Lösen mit Salpetersüür (HNO3) ansüert, mit 1 ml vun en Ether oder Amylalkohol överschicht un wenige Drapens Waterstoffperoxid (H2O2) tosett. Denn warrt schüttelt. Chrom(VI)-Peroxid warrt anwiest dör en Blaufarven vun’n Ether. De Ether deent hier blots dorto, dat Chromperoxid bestännig to hollen, wiel dat anners na en Tiet wedder verfallt ünner Afgaav vun Suerstoff.
- Cr2O72− + 4 H2O2 + 2 H+ → 2 CrO(O2)2 + 5 H2O
Verfall:
- 4 CrO(O2)2 + 12 H+ → 4 Cr3+ + 6 H2O + 7 O2
Ok bi de Vörproven bi’t Smölten vun de Soltperl mit Phosphorsolt (NaNH4HPO4) oder Borax (Dinatriumtetraborat, Na2B4O7) gifft dat en charakteristisch Klöör tohopen mit de Solten vun Swormetallen (gröön mit Cr3+). Bi de Oxidatschoonssmölt mit Soda un Salpeter dorgegen warrt Chrom-III to chromat oxideert (gele Klöör).
Sekerheit[ännern | Bornkood ännern]
Metallsch Chrom un Chrom(III)-Verbinnen sind normalerwies nich schlimm för de Gesundheit. In Gegensatz dorto sünd Chrom(VI)-Verbinnen över den Mund opnahmen as bannig giftig antosehn. De döödlich Dosis is ungefäähr en halfen Teelepel vull. Chrom(VI)-Verbinnen sünd ok lang al as kreeftveroorsakend bekannt. Se warrt ünner annern in Köhlsystemen verwendt. De meisten Chrom(VI)-Verbinnen maakt Irritatschonen an Ogen, Huut un Schliemhüüt. Chronisch Kontakt mit Chrom(VI)-Verbinnen künnt to anhollend Schaden föhren, wenn dat nich behannelt warrt.
1958 hett de Weltgesundheitsorganisatschoon (WHO) för Chrom(VI)-Verbinnen en hööchste tolaten Konzentratschoon vun 0,05 mg/l in’t Drinkwater anraadt. Wietere Ünnersöken hebbt nich to en Ännern vun dissen Raatslag föhrt. Siet 2006 is Chrom(VI) in de Elektroindustrie (EU-Richtlien över Elektroredschoppen) un siet 2007 in de Automibilindustrie (EU-Autorichtlien) verboden.
Verwennen un Verbinnen[ännern | Bornkood ännern]
Bruuk[ännern | Bornkood ännern]

Chrom un Verbinnen dorvun warrt op verscheeden Rebeden insett:
Hartverschromen: Dat is dat galvaansch Opbringen vun en bit to 1 mm dicke Schuulschicht direkt op Stahl, Kopper oder Gussiesen. Ok Aluminium kann na Opbringen vun en Twüschenschicht verschromt warrn. Verchromte Lichtmetallfelgen warrt t. B. bi’t Autotuning geern bruukt.
Dekorverchromen: Dormit warrt dat galvaansch Obringen vun en < 1 μm dicken Schicht Chrom meent, wat as Dekor mit en korrosionsschulend Twüschenschicht ut Nickel oder Nickel-Kopper anwendt warrt. Faken warrt ok Kunststoffdelen verschromt. An Steed vun de Dekorverschromen gifft dat ok Achrolyte-Verfohren.
Legeerenelement: Chrom is Bestanddeel vun korrosions- un hittbestännige Stahloorden un Legeeren.
Katalysater: As Katalysater warrt Chrom insett, üm cheemsch Reakschonen gau oder överhööft erst mööglich to maken.
Chromgarven: dat is dat bedüdenste Verfohren bi’t Herstellen vun Ledder.
Verbinnen[ännern | Bornkood ännern]
Veele Chromverbinnen deent as Farvpigment, aver dat gifft ok en poor annere Anwennen.
- Chromit warrt insett bi’t Herstellen vun Formen för’t Brennen vun Tegelstenen.
- Chrom(IV)-oxid oder Chromdioxid (CrO2) is en swart ferromagneetsch Pulver, dat bi’t Herstellen vun Magnetbänner mit en beter Signal-Ruusch-Proportschoon as de konventionellen Iesenoxid-Bänner bruutk, vun wegen de högere Koerzivität vun’t Chromdioxid.
- Chromgröön is dat gröne Chrom(III)-oxid (Cr2O3), dat as Farv för Emaille verwennt warrt aver ok to’n Farven vun Glas, wat dordör smaragdgrön warrt.
- Chromgeel is en geel Bliechromat (PbCrO4), dat fröher as lüchtend Farvpigment („Postgeel“) verwennt worrn is. Vun wegen sien Giftigkeit warrt dat vundaag kuum noch bruukt un is dör orgaansch Farvpigmenten uttuuscht. Dat Pigment, dat as Künstlerfarv bruukt warrt, is na herstellen en Bliesulfat/Bliechromat (ruch weg 2PbSO4·PbCrO4). Dat Pigment weer 1809 vun Vauquelin opdeckt un warrt siet 1820 in Düütschland kommerziell herstellt. Dat Pigment hett en hooge Deckkraft, sien Lichtbestännigkeit hangt vun den Geeltoon af. In de Öölmaleree warrt Chromgeel kuum bruukt, man Vincent van Gogh hett dat bruukt, as he t. B. sienberopen Sünnbloombiller maalt hett. De Farv ännert sik aver mit de Tiet, dör den Verfall vu Chromgeel to Bliesulfid.
- Kaliumdichromat is organgeklöört un gellt as stark Oxidatschoonsmiddel. Dat warrt to’n Reinigen vun Laborredschoppen nütt (in Swevelsüür as Chromswevelsüür, de bannig kreeftutlösend is) un as Middel to’n Titreeren, aver ok to’n Fixeeren in industriell Farvbaden. Kaliumdichromat un Ammoniumdichromat sündok die lichtfienföhlig Stoffen in Chromgelantineschichten, de in de fröhe fotografie bruukt weern (kiek ok bi: Eddeldruckverfohren).
Literatur[ännern | Bornkood ännern]
- A. Pollack: Zwanzig Jahre Verchromung. Chemiker-Zeitung 67(21), S. 279–280 (1943), ISSN 0009-2894
- Reinhard Schliebs: Die technische Chemie des Chroms. Chemie in unserer Zeit 14(1), S. 13–17 (1980), ISSN 0009-2851
- John B. Vincent (2004). Recent advances in the nutritional biochemistry of trivalent chromium. Proceedings of the Nutrition society, 63, 41–47

